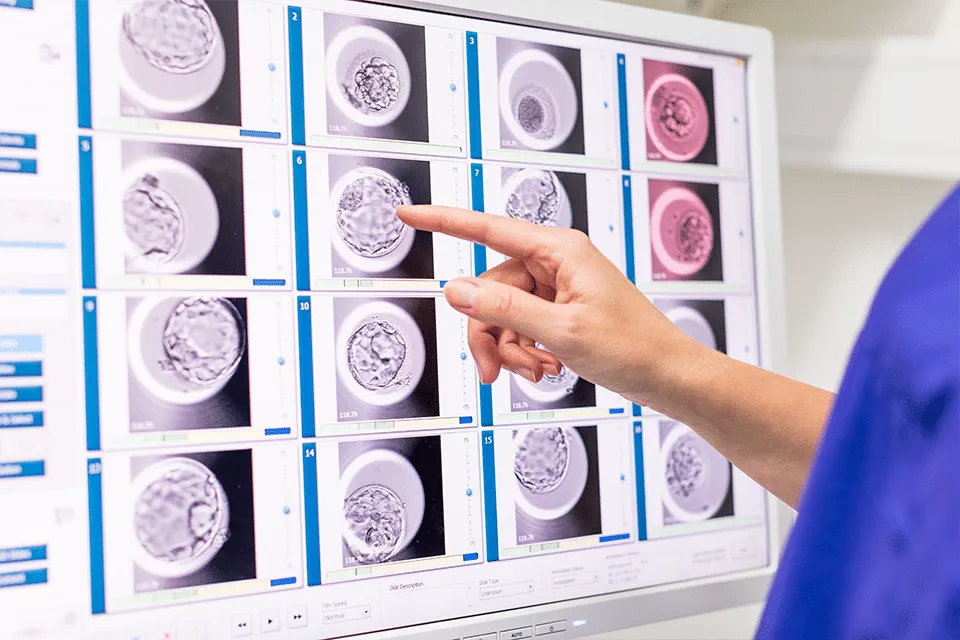
عوامل مؤثر بر موفقیت IVF

لقاح آزمایشگاهی (IVF) به عنوان یکی از مهمترین روشهای کمکباروری (ART)، طی دهههای اخیر نقش تعیینکنندهای در درمان ناباروری ایفا کرده است. با وجود پیشرفتهای چشمگیر در توسعه داروهای تحریک تخمدان، تکنیکهای لقاح، محیطهای کشت جنین و فناوریهای ارزیابی جنین، موفقیت IVF همچنان با نوسان قابلتوجهی همراه است. این نوسان نهتنها بین بیماران مختلف، بلکه حتی بین چرخههای متوالی یک بیمار نیز مشاهده میشود.
تفاوت در نرخ بارداری در IVF نشان میدهد که موفقیت این روش صرفاً وابسته به یک عامل منفرد نیست، بلکه نتیجه تعامل پیچیدهای از عوامل بیولوژیک، بالینی، آزمایشگاهی و حتی رفتاری بیمار است. از سن و ذخیره تخمدانی گرفته تا کیفیت جنین، شرایط آزمایشگاه IVF و مهارت تیم درمانی، همگی میتوانند بهصورت مستقیم یا غیرمستقیم بر نتیجه نهایی درمان تأثیر بگذارند.
در این مقاله، ما به بررسی جامع عوامل مؤثر بر موفقیت چرخههای IVF، شواهد علمی مرتبط، راهکارهای بهینه برای افزایش شانس موفقیت IVF و انتظارات واقعبینانه در سنین مختلف میپردازیم.
IVF چیست و چگونه عمل میکند؟
IVF فرآیندی پزشکی است که طی آن تخمکها از تخمدانها بیرون کشیده و در آزمایشگاه با اسپرم بارور میشود. سپس جنینهای تشکیلشده به رحم منتقل میشوند تا لانهگزینی و بارداری ایجاد شود. این روش معمولاً در مواردی مانند انسداد لولههای فالوپ، اندومتریوز، ناباروری مردانه، سن بالای مادر و شکست درمانهای قبلی باروری به کار گرفته میشود.
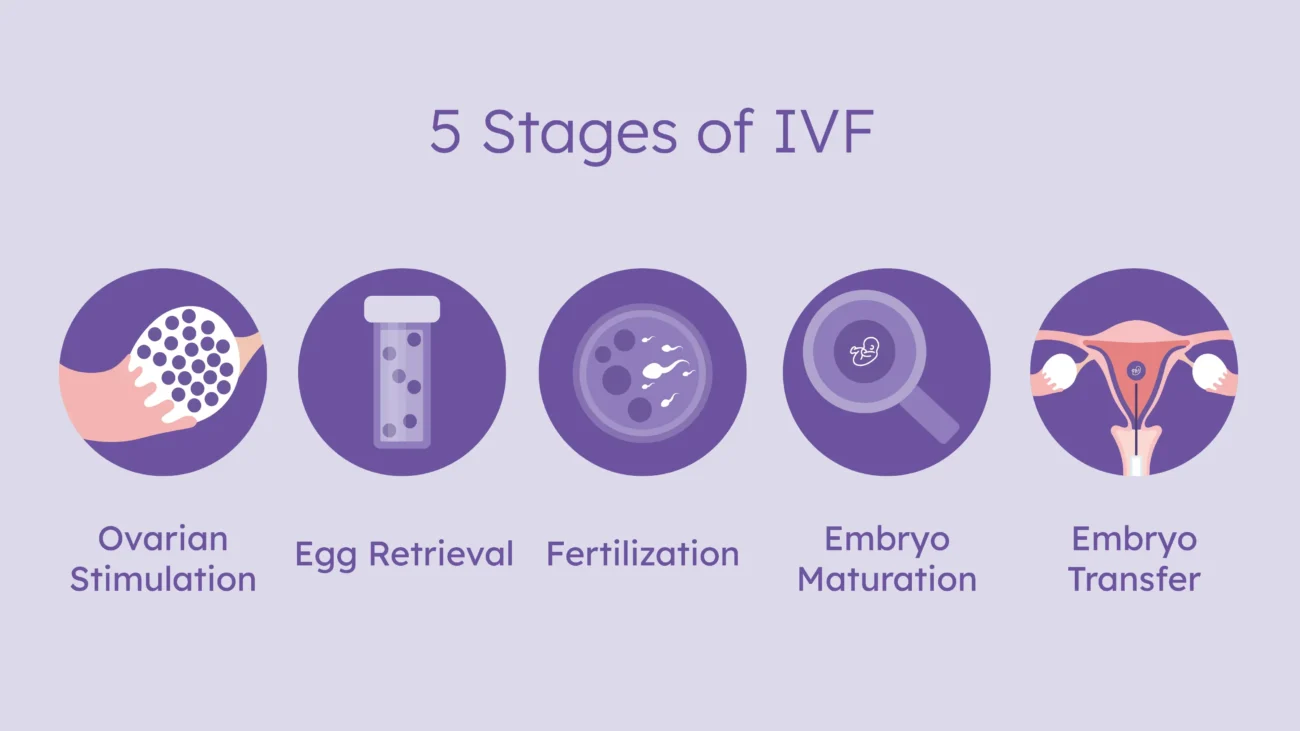
اهمیت شناخت عوامل موفقیت IVF
با وجود اینکه IVF بهعنوان درمان استاندارد ناباروری شناخته شده و میلیونها خانواده را در سراسر جهان به فرزندآوری رسانده است، نرخ موفقیت آن به عوامل متعددی بستگی دارد. شناخت این عوامل میتواند به بیمار کمک کند:
- آگاهانه تصمیمگیری کند.
- انتظارات واقعبینانه داشته باشد.
- با پزشک متخصص خود برنامه درمانی بهتری تدوین کند.
- شانس موفقیت را با راهکارهای علمی افزایش دهد.
عوامل موفقیت در IVF
در این بخش به توضیح نقش هر یک از عوامل موفقیت چرخههای IVF میپردازیم:
سن زن و ذخیره تخمدانی
سن زن و وضعیت ذخیره تخمدانی مهمترین و پایدارترین عوامل بیولوژیک در پیشبینی موفقیت چرخههای IVF محسوب میشوند. شواهد اپیدمیولوژیک نشان میدهد پس از ۳۵ سالگی، نرخ بارداری بالینی و تولد نوزاد زنده بهصورت پیشرونده کاهش مییابد و این افت پس از ۴۰ سالگی شدت بیشتری پیدا میکند. علت اصلی این روند، کاهش کیفیت اووسیتها و افزایش بروز ناهنجاریهای کروموزومی بهویژه آنئوپلوئیدی است که منجر به کاهش شانس لانهگزینی و افزایش خطر سقط جنین میشود. ذخیره تخمدانی که با شاخصهایی مانند AMH، FSH پایه و شمار فولیکولهای آنترال ارزیابی میشود، نمایانگر کمیت اووسیتهاست و اگرچه مستقیماً بیانگر کیفیت تخمک نیست، اما کاهش آن معمولاً با پاسخ ضعیف به تحریک تخمدان و افت نتایج IVF همراه است.
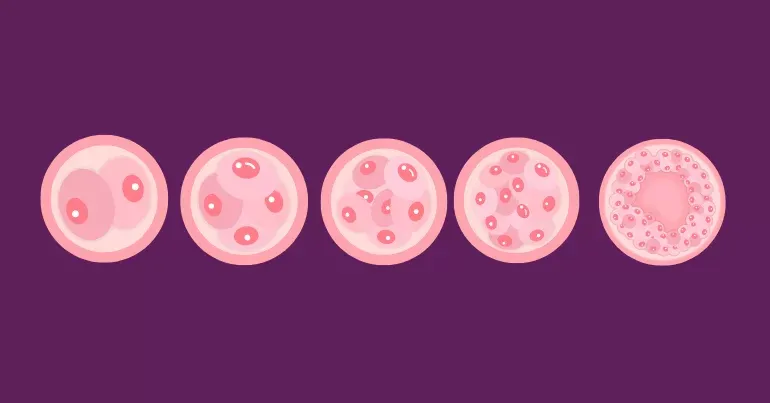
بهطور خلاصه، با افزایش سن زن در IVF پیامدهای زیر مشاهده میشود:
- کاهش کیفیت ژنتیکی اووسیتها
- افزایش ریسک آنئوپلوئیدی و سقط جنین
- کاهش نرخ لانهگزینی جنین
- کاهش نرخ تولد نوزاد زنده در هر چرخه IVF
دادههای بالینی نشان میدهد نرخ تولد زنده در زنان زیر ۳۵ سال حدود ۴۰ تا ۵۵ درصد در هر چرخه IVF است، در حالی که این میزان در ۴۰ سالگی به حدود ۱۵ تا ۲۰ درصد، در ۴۳ سالگی به حدود ۵ درصد و در سنین ۴۵ سال و بالاتر به کمتر از ۱ درصد با استفاده از تخمکهای خود بیمار کاهش مییابد. بر این اساس، ارزیابی دقیق سن و ذخیره تخمدانی برای انتخاب پروتکل تحریک مناسب، پیشبینی پاسخ تخمدان و ارائه مشاوره واقعبینانه به بیمار پیش از شروع درمان ضروری است.
| گروه سنی | نرخ تولد زنده در هر چرخه IVF |
| زیر 35 سال | 40–55٪ |
| 35–37 سال | 30–40٪ |
| 38–39 سال | 20–30٪ |
| 40 سال | 15–20٪ |
| 41–42 سال | 10–15٪ |
| 43 سال | 5٪ |
| 45 سال و بالاتر | <1٪ |
کیفیت اووسیت و تأثیر آن بر نتایج IVF
کیفیت اووسیت عامل بنیادی در تمام مراحل چرخه IVF است. اووسیت سالم باید قادر به تکمیل تقسیم میوزی، لقاح طبیعی و حمایت از رشد اولیه جنین باشد. اختلال در هر یک از این مراحل میتواند منجر به تشکیل جنینهای با پتانسیل رشد پایین شود.
عوامل متعددی از جمله افزایش سن، استرس اکسیداتیو، اختلالات متابولیک، اندومتریوز و شرایط التهابی میتوانند کیفیت اووسیت را تحت تأثیر قرار دهند. نقصهای میتوکندریایی در اووسیتهای مسنتر، یکی از مکانیسمهای کلیدی کاهش کیفیت محسوب میشود.
کیفیت اسپرم و فاکتورهای مردانه
ناباروری مردانه بهتنهایی یا در ترکیب با فاکتورهای زنانه، سهم قابلتوجهی در شکست چرخههای IVF دارد. علاوه بر پارامترهای کلاسیک آنالیز اسپرم (تعداد، تحرک و مورفولوژی)، شاخصهای عملکردی پیشرفتهتر مانند شکست DNA اسپرم (SDF) در روند موفقیت IVF اهمیت ویژهای یافتهاند.
افزایش SDF با کاهش نرخ لقاح، اختلال در رشد جنین، کاهش تشکیل بلاستوسیست و افزایش سقط جنین مرتبط است. این اثرات حتی در چرخههای ICSI نیز گزارش شدهاند که نشان میدهد ICSI نمیتواند بهطور کامل اثرات منفی آسیب DNA اسپرم را خنثی کند.
پاسخ تخمدان به تحریک و شرایط هورمونی
پاسخ تخمدان به تحریک کنترلشده و شرایط هورمونی بیمار از عوامل کلیدی و تعیینکننده در موفقیت چرخههای IVF محسوب میشود، زیرا پاسخ مناسب میتواند تعادلی مؤثر میان کمیت و کیفیت اووسیتهای تولیدشده ایجاد کند. در موارد پاسخ ضعیف به تحریک تخمدان، تعداد اووسیتهای قابل برداشت کاهش مییابد و این موضوع شانس تشکیل جنینهای باکیفیت و انتقال موفق را محدود میکند، در حالیکه پاسخ بیشازحد به تحریک تخمدان ممکن است با اختلال در کیفیت اووسیت و اندومتر، افزایش سطح استرادیول و بالا رفتن خطر بروز سندرم تحریک بیشازحد تخمدان (OHSS) همراه باشد.
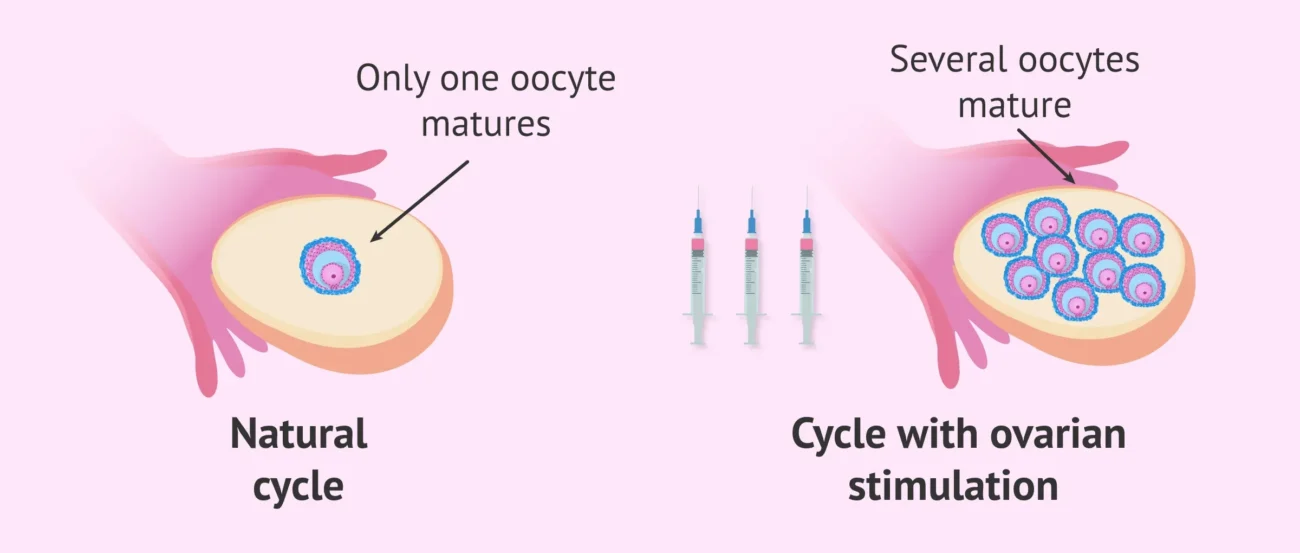
از سوی دیگر، شرایط هورمونی در IVF، به ویژه سطوح استرادیول و پروژسترون در طول تحریک، نقش مهمی در هماهنگی رشد فولیکولی و آمادهسازی اندومتر برای لانهگزینی ایفا میکند؛ بهطوریکه افزایش زودرس پروژسترون میتواند موجب جابهجایی پنجره لانهگزینی و کاهش نرخ بارداری بالینی شود. ارزیابی ذخیره تخمدان با شاخصهایی مانند AMH، FSH پایه و شمار فولیکولهای آنترال (AFC) به پزشک امکان میدهد پاسخ احتمالی به تحریک تخمدان را پیشبینی کرده و با انتخاب پروتکلهای تحریک تخمدان فردمحور شامل گنادوتروپینها و آنالوگهای GnRH، حداکثر تعداد اووسیت بالغ و قابل استفاده را با حداقل عوارض تولید کند؛ رویکردی که بهطور مستقیم با افزایش موفقیت IVF و بهبود نتایج درمان ناباروری ارتباط دارد.
پروتکلهای تحریک تخمدان (COH) و نقش آنها در موفقیت IVF
تحریک کنترلشده تخمدان (Controlled Ovarian Hyperstimulation یا COH) یکی از مراحل کلیدی در چرخههای IVF است که با هدف تولید چند اووسیت بالغ و قابل استفاده انجام میشود. انتخاب پروتکل مناسب COH تأثیر مستقیمی بر پاسخ تخمدان، کیفیت اووسیتها، هماهنگی اندومتر و در نهایت موفقیت IVF دارد. از آنجا که پاسخ تخمدان در زنان متفاوت است، پروتکلهای تحریک باید بهصورت فردمحور و براساس سن، ذخیره تخمدانی، سطح LH و سابقه پاسخ بیمار طراحی شوند.
مهمترین پروتکلهای تحریک تخمدان مورد استفاده در IVF عبارتاند از:
- پروتکل طولانی (Long GnRH Agonist Protocol):
در پروتکل طولانی آگونیست، مهار ترشح هورمون LH پیش از شروع تحریک تخمدان باعث رشد هماهنگ فولیکولها و جلوگیری از تخمکگذاری زودرس میشود. این کنترل هورمونی منجر به پاسخ قابلپیشبینیتر تخمدان به گنادوتروپینها و افزایش یکنواختی در بلوغ فولیکولها میشود. این پروتکل معمولاً برای زنانی با ذخیره تخمدانی مناسب و پاسخ تخمدانی نرمال یا بالا توصیه میشود، اگرچه طول دوره درمان و تعداد تزریقات در مقایسه با سایر پروتکلها بیشتر است. - پروتکل Microflare GnRH Agonist:
در پروتکل فلر آگونیست، تجویز کوتاهمدت آگونیست GnRH موجب افزایش اولیه ترشح درونزاد FSH و LH (اثر فلر) میشود که با هدف بهبود پاسخ تخمدان در بیماران با پاسخ تخمدانی ضعیف به کار میرود. این افزایش زودهنگام FSH میتواند به تحریک فولیکولهای آنترال کمک کند، اما افزایش همزمان LH در مراحل ابتدایی فولیکولوژنز ممکن است در برخی بیماران، به ویژه زنان با سن بالا یا مبتلایان به سندرم تخمدان پلیکیستیک (PCOS) بر کیفیت اووسیت و بلوغ فولیکولی اثر منفی بگذارد. - پروتکل GnRH Antagonist همراه با Estrogen Priming:
این روش با جلوگیری از تخمکگذاری زودرس و انعطافپذیری بیشتر در کنترل چرخه، به ویژه در زنان با ذخیره تخمدان پایین یا LH بالا کاربرد دارد و امروزه یکی از پرکاربردترین پروتکلهای COH محسوب میشود.
جدول مقایسه پروتکلهای تحریک تخمدان در IVF
| پروتکل تحریک | مزایا | محدودیتها | مناسب برای |
| Long GnRH Agonist | کنترل دقیق LH، پاسخ یکنواخت | طولانی بودن درمان، تزریقات بیشتر | زنان با تخمدان حساس |
| Microflare | افزایش پاسخ تخمدان در پاسخدهندگان ضعیف | احتمال LH بالا و کاهش کیفیت اووسیت | برخی بیماران با پاسخ ضعیف یا PCOS |
| GnRH Antagonist | جلوگیری از تخمکگذاری زودرس، انعطافپذیری بالا | نیاز به پایش دقیق هورمونی | زنان با ذخیره تخمدان پایین یا سن بالا |
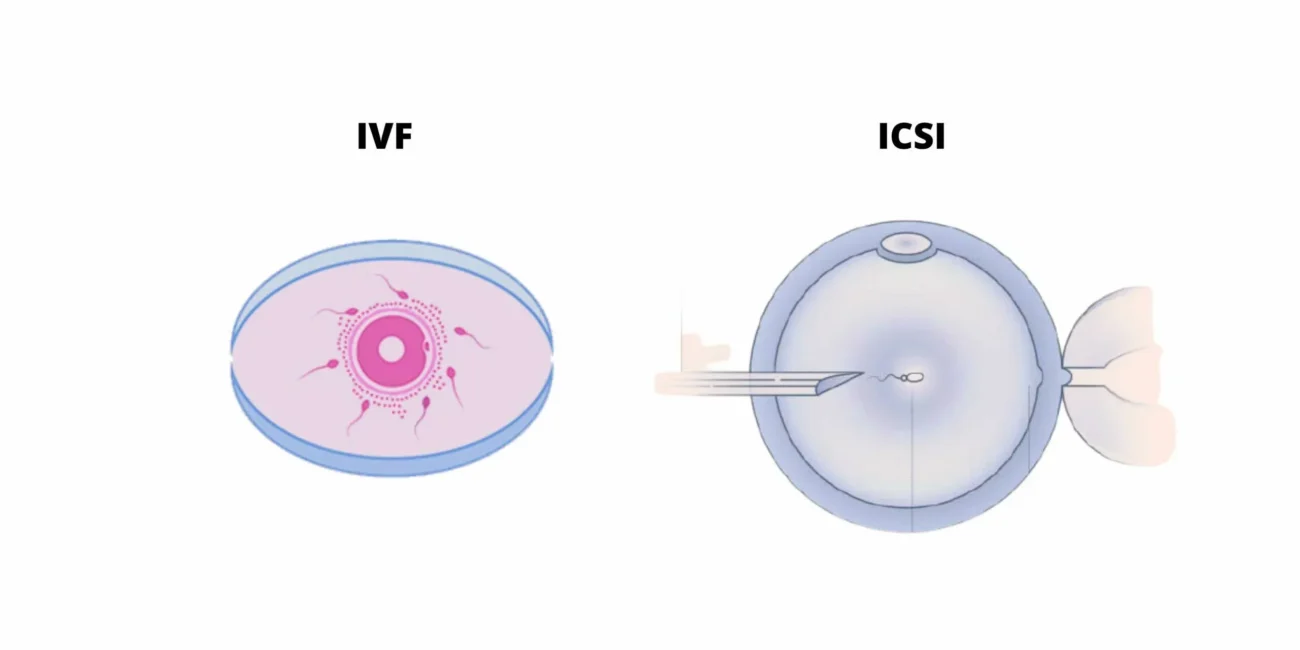
انتخاب تکنیک لقاح: IVF کلاسیک یا ICSI
انتخاب تکنیک لقاح در چرخههای IVF باید براساس اندیکاسیونهای علمی و شرایط فردی زوج انجام شود. روش ICSI به طور ویژه در موارد ناباروری مردانه شدید، تعداد کم اووسیتهای قابل استفاده، کیفیت پایین اسپرم یا سابقه شکست لقاح در چرخههای قبلی توصیه میشود. در مقابل، شواهد بالینی نشان میدهد که استفاده روتین از روش ICSI در زوجهایی که ناباروری آنها ناشی از اختلالات شدید پارامترهای اسپرم نیست، لزوماً باعث افزایش نرخ بارداری یا تولد نوزاد زنده در مقایسه با IVF کلاسیک نمیشود.
شرایط آزمایشگاه IVF و محیط کشت جنین
آزمایشگاه IVF یکی از حساسترین اجزای درمانهای کمکباروری است و کیفیت آن تأثیر مستقیمی بر رشد جنین و موفقیت نهایی چرخه IVF دارد. محیط کشت باید شرایطی نزدیک به محیط طبیعی بدن را شبیهسازی کند.
عوامل کلیدی آزمایشگاه IVF شامل:
- ثبات دمایی (۳۷ درجه سانتیگراد)
- pH و اسمولالیته کنترلشده
- ترکیب دقیق گازها (CO₂، O₂ و N₂)
- کیفیت و استاندارد محیطهای کشت جنین
مطالعات نشان دادهاند که کشت جنین در شرایط اکسیژن پایین (حدود ۵٪) نسبت به شرایط اتمسفریک، با کاهش استرس اکسیداتیو و بهبود رشد بلاستوسیست همراه است.
فناوریهای مؤثر در موفقیت آزمایشگاه IVF شامل موارد زیر است:
- انکوباتورهای پیشرفته
- سیستمهای تایملپس
- اجرای دقیق برنامههای QC/QA
نقش مهارت و تجربه جنینشناس
با وجود پیشرفت فناوری، عامل انسانی همچنان یکی از تعیینکنندهترین عوامل موفقیت IVF به شمار میآید. مهارت جنینشناس میتواند تفاوت قابل توجهی در نتایج ایجاد کند.
وظایف کلیدی جنینشناس در چرخه IVF:
- انجام دقیق ICSI
- مدیریت و آمادهسازی گامتها
- ارزیابی مورفولوژیک جنین
- انتخاب جنین مناسب برای انتقال
بسیاری از تصمیمهای حیاتی، مانند انتخاب زمان انتقال یا جنین مناسب، بر پایه تجربه عملی و قضاوت حرفهای انجام میشوند.
کیفیت جنین و زمان انتقال
کیفیت جنین یکی از قویترین پیشبینیکنندههای موفقیت IVF است. ارزیابی دقیق جنینها امکان انتخاب جنین با بیشترین پتانسیل لانهگزینی را فراهم میکند.
معیارهای ارزیابی کیفیت جنین:
- تعداد و تقارن سلولها
- میزان فرگمنتیشن
- کیفیت بلاستوسیست
- الگوی تقسیم سلولی (در سیستمهای تایملپس)
مقایسه زمان انتقال جنین:
| زمان انتقال جنین | مزایا | محدودیتها | مناسب برای |
|---|---|---|---|
| روز ۳ (مرحله کلیواژ) | کاهش ریسک توقف رشد جنین در آزمایشگاه مناسب در تعداد کم جنین | قدرت انتخاب محدودتر همزمانی کمتر با پنجره لانهگزینی | بیماران با تعداد جنین محدودPoor Responderها |
| بلاستوسیست – روز ۵ یا ۶ | انتخاب دقیقتر جنین با پتانسیل بالا هماهنگی بهتر با اندومتر نرخ لانهگزینی بالاتر در بیماران منتخب | نیاز به جنینهای با کیفیت کافی ریسک عدم رسیدن به انتقال | بیماران با تعداد جنین مناسب موارد کاندید SET یا PGT-A |
انتقال تکجنینی انتخابی (SET) روشی ایمن برای کاهش خطر بارداری چندقلویی است.
پذیرش اندومتر و لانهگزینی
حتی بهترین جنینها بدون اندومتر پذیرنده قادر به لانهگزینی نیستند. پذیرش اندومتر عامل نهایی موفقیت چرخه IVF محسوب میشود.
عوامل مؤثر بر پذیرش اندومتر:
- ضخامت مناسب اندومتر (≥ ۷–۸ میلیمتر)
- الگوی سونوگرافیک مطلوب
- هماهنگی با پنجره لانهگزینی
- وضعیت حفره رحم
اختلال در هر یک از این عوامل میتواند منجر به شکستهای مکرر IVF شود.
سبک زندگی و وضعیت عمومی بیمار
سبک زندگی نقش مهمی در کیفیت گامتها، پاسخ به تحریک و پذیرش اندومتر دارد.
عوامل منفی تاثیرگذار بر موفقیت IVF:
- مصرف سیگار
- BMI خارج از محدوده طبیعی
- استرس مزمن
- اختلالات متابولیک
اقدامات توصیه شده پیش از شروع IVF:
- اصلاح رژیم غذایی
- حفظ وزن مناسب
- ترک سیگار حداقل ۳ ماه قبل از درمان
- مدیریت استرس و خواب
تأثیر سابقه بارداری و مشکلات ناباروری بر موفقیت IVF
سابقه باروری موفق نشاندهندهی سلامت دستگاه تناسلی و عملکرد طبیعی اندامهای تولیدمثل است و میتواند شانس موفقیت چرخههای IVF را افزایش دهد. از سوی دیگر، برخی شرایط ممکن است شانس موفقیت را کاهش دهند. مهمترین این عوامل عبارتند از:
- فیبرومها و ناهنجاریهای رحمی: تغییرات ساختاری در رحم میتواند لانهگزینی را دشوار کند.
- اختلال عملکرد تخمدان: کاهش کیفیت یا کمیت اووسیتها بر موفقیت IVF تأثیر مستقیم دارد.
- ناباروری دوطرفه: وجود مشکلات هم در زن و هم در مرد، روند درمان را پیچیدهتر میکند.
- مدت طولانی تلاش برای بارداری: تأخیر در مراجعه به مرکز درمان ناباروری، شانس موفقیت را کاهش میدهد.
بررسی دقیق سابقه باروری و ارزیابی مشکلات ناباروری قبل از شروع درمان، کمک میکند تا پروتکل مناسب IVF انتخاب شده و انتظارات واقعبینانه تعیین شود.
انتقال جنین: تازه و منجمد، تک یا چند جنینی
انتخاب روش انتقال جنین یکی از حساسترین مراحل IVF است و تأثیر مستقیمی بر موفقیت چرخه دارد. مهمترین گزینهها شامل:
1. انتقال جنین تازه در مقایسه با جنین منجمد (ET vs FET)
2. انتقال تک جنینی در مقایسه با چندجنینی (SET vs MET)
- MET (چند جنینی): افزایش ریسک حاملگی چندقلویی و عوارض مرتبط
- SET (تک جنینی): کاهش ریسک چندقلویی، امکان ترکیب با PGT-A برای انتخاب جنین سالم
انتقال تکجنینی (SET) همراه با انتخاب جنین براساس کیفیت و تست ژنتیکی، بهترین گزینه برای اکثر بیماران است.
| روش انتقال | مزایا | معایب |
| ET (تازه) | نرخ بارداری بالاتر در برخی مطالعات | ریسک سقط مشابه FET، نیاز به همزمانی دقیق با تحریک تخمدان |
| FET (منجمد) | نرخ تولد زنده مشابه ET، ریسک کمتر زایمان زودرس | نیاز به فرآیند آمادهسازی اندومتر و زمانبندی دقیق |
انتخاب روش مناسب انتقال جنین بسته به شرایط بیمار، سن، کیفیت جنین و سابقه باروری انجام میشود و میتواند شانس موفقیت IVF را تا حد زیادی بهبود دهد.
تکنیکهای پیشرفته برای افزایش موفقیت IVF
پیشرفتهای تکنولوژیک امکان بهینهسازی نتایج لقاح آزمایشگاهی را فراهم کردهاند، بهویژه در بیماران پرخطر یا زنان بالای ۳۵ سال. مهمترین روشهای کمکی شامل موارد زیر است:
- آزمایش ژنتیکی پیش از لانهگزینی (PGT-A): انتخاب جنینهای euploid به کاهش ریسک سقط و افزایش شانس تولد زنده کمک میکند. این تکنیک به ویژه برای زنان بالای ۳۵ سال و کسانی که سابقه شکست چرخه IVF یا سقط مکرر دارند، اهمیت دارد.
- تزریق اسپرم به داخل تخمک (ICSI یا میکرواینجکشن اسپرم): این روش برای ناباروری مردانه شدید، تعداد کم اووسیت یا سابقه لقاح ناموفق توصیه میشود. استفاده روتین از ICSI در بیمارانی که مشکل ناباروری مردانه ندارند، شانس بارداری را به طور قابل توجهی افزایش نمیدهد.
- هچینگ کمکی (Assisted Hatching): این تکنیک به جنین کمک میکند تا از پوسته خارجی خود خارج شود و لانهگزینی موفقتری داشته باشد. کاربرد آن محدود به اندیکاسیونهایی مانند جنینهای حاصل از زنان با سن بالای باروری، پوسته ضخیم یا سابقه شکست لانهگزینی است.
- انکوباتورهای تایملپس: این سیستمها رشد جنین را به صورت مداوم و بدون باز کردن انکوباتور پایش میکنند. امکان بررسی دقیق رفتار جنین و انتخاب بهترین جنین برای انتقال، شانس موفقیت IVF را افزایش میدهد.

انتظارات واقعبینانه برای IVF در سنین بالای ۴۰: شانس بارداری و راهکارهای بهبود موفقیت
با افزایش سن، به ویژه پس از 40 سالگی، موفقیت چرخههای IVF کاهش مییابد. این کاهش عمدتاً به کاهش کیفیت و کمیت تخمکها و افزایش ناهنجاریهای کروموزومی مرتبط است. مطالعات بالینی نشان میدهند که نرخ تولد زنده با تخمک خود زن در سن 40 حدود ۱۵–۲۰٪ است و در 43 سالگی به حدود ۵٪ کاهش مییابد. در سنین بالای 45، موفقیت با تخمک خود زن به کمتر از ۱٪ میرسد. این آمار نشان میدهد که برای زنان بالای 40، انتظارات واقعبینانه در IVF ضروری است.
برای بهبود شانس موفقیت در این گروه سنی، نکات زیر اهمیت دارد:
- تکرار چرخههای IVF: موفقیت در اولین چرخه کمتر رایج است. انجام 2 تا 3 چرخه متوالی میتواند نرخ تولد زنده را بهطور قابل توجهی افزایش دهد.
- استفاده از تخمک اهدایی: برای زنانی که کیفیت تخمک آنها پایین است، تخمک اهدا شده از زنان جوانتر شانس تولد زنده را تا بیش از 50٪ افزایش میدهد.
- مدیریت پزشکی دقیق: بررسی ذخیره تخمدان، پروتکل تحریک تخمدان شخصیسازی شده و نظارت دقیق بر اندومتر و کیفیت جنین اهمیت بالایی دارد.
- حمایت روانی و سبک زندگی: حفظ آرامش، حمایت خانواده، تغذیه سالم، وزن متعادل و ترک سیگار، نقش مهمی در افزایش شانس موفقیت IVF دارند.
- مشاوره واقعبینانه با پزشک: گفتگو با متخصص باروری درباره زمانبندی، تکنیکهای پیشرفته مانند PGT-A و گزینههای جایگزین، به تنظیم انتظارات کمک میکند.
جدول نرخ تولد زنده بر اساس سن و نوع تخمک
| سن زن | تخمک خود زن | تخمک اهدایی |
| 40 | 15–20٪ | 50–60٪ |
| 43 | 5٪ | 50٪ |
| 45+ | <1٪ | 45–50٪ |
این دادهها نشان میدهد که حتی در سنین بالای 40، با برنامهریزی دقیق، استفاده از تخمک اهدایی و استراتژیهای شخصیسازی شده، IVF میتواند مسیر موفقی برای فرزندآوری فراهم کند. کلید موفقیت در این سنین، ترکیب دانش پزشکی، تکنولوژی پیشرفته و آمادهسازی جسمی و روانی بیمار است.
خلاصه مطلب: عوامل کلیدی موفقیت در چرخههای IVF و نقش فناوریهای نوین
موفقیت در چرخههای لقاح آزمایشگاهی (IVF) حاصل یک عامل واحد نیست، بلکه نتیجه تعامل پیچیده و چندبعدی میان عوامل بیولوژیک، بالینی، آزمایشگاهی و سبک زندگی بیمار است. سن زن و کیفیت ژنتیکی اووسیتها، پاسخ تخمدان به تحریک، شرایط هورمونی، کیفیت جنین، پذیرش اندومتر و زمانبندی دقیق انتقال، همگی به صورت زنجیرهوار بر نتیجه نهایی تأثیر میگذارند. در کنار این عوامل، علت ناباروری، سابقه باروری، انتخاب تکنیک لقاح مناسب (IVF کلاسیک یا ICSI) و تصمیمگیری درباره انتقال جنین تازه یا فریز شده، نقش تعیینکنندهای در نرخ بارداری و تولد نوزاد زنده دارند.
از سوی دیگر، کیفیت عملکرد آزمایشگاه IVF و مهارت تیم جنینشناسی، یکی از مهمترین ارکان موفقیت درمان محسوب میشود. شرایط کنترلشده محیط کشت جنین، استفاده از انکوباتورهای پیشرفته، سیستمهای تایملپس، اجرای دقیق برنامههای کنترل کیفیت (QC/QA) و بهرهگیری آگاهانه از تکنیکهای پیشرفتهای مانند PGT-A، Assisted Hatching و انتقال تکجنینی انتخابی (SET)، امکان انتخاب جنین با بالاترین پتانسیل لانهگزینی را فراهم میکند. این رویکرد مبتنی بر شواهد، بهویژه در بیماران با سن بالا یا سابقه شکستهای مکرر IVF، اهمیت دوچندان دارد.
در نهایت، بهینهسازی سبک زندگی بیمار پیش از شروع درمان، شامل اصلاح تغذیه، حفظ BMI مناسب، ترک سیگار، مدیریت استرس و آمادهسازی جسمی و روانی، بخش جداییناپذیر از مدیریت جامع ناباروری است. حتی پیشرفتهترین فناوریهای کمکباروری نیز بدون توجه به این عوامل زمینهای، نمیتوانند حداکثر اثربخشی خود را نشان دهند. بنابراین، موفقیت IVF نیازمند رویکردی فردمحور، هماهنگ و مبتنی بر شواهد علمی است که در آن تصمیمات بالینی و آزمایشگاهی در کنار هم اتخاذ شوند.
پارس ژن پویا
در این مسیر، دسترسی به تجهیزات استاندارد و فناوریهای پیشرفته IVF نقش کلیدی دارد. شرکت پارس ژن پویا با ارائه طیف کاملی از تجهیزات و محصولات تخصصی حوزه IVF، از جمله سیستمهای میکرومانیپولیشن، میکروسکوپهای تخصصی IVF، انکوباتورهای جنین، تجهیزات مرتبط با ICSI، لیزر هچینگ، به مراکز درمان ناباروری کمک میکند تا چرخههای IVF را با بالاترین سطح دقت، ایمنی و کارایی اجرا کنند. بهرهگیری از این تجهیزات، در کنار دانش بالینی و آزمایشگاهی، میتواند گامی مؤثر در جهت بهینهسازی نتایج درمان و افزایش شانس تولد نوزاد سالم باشد.
منبع: pmc، sciencedirect