PCR چیست و چرا هنوز هم مفیدترین تکنیک آزمایشگاهی است؟
واکنش زنجیرهای پلیمراز (PCR) یکی از مهمترین نوآوریهای زیستشناسی مولکولی در تاریخ علم محسوب میشود که تأثیر آن فراتر از مرزهای آزمایشگاههای تحقیقاتی رفته و به طور مستقیم بر تشخیص، درمان و پیشگیری از بیماریها اثر گذاشته است. این تکنیک که برای نخستین بار امکان تکثیر هدفمند DNA را در شرایط آزمایشگاهی فراهم ساخت، بنیان بسیاری از فناوریهای تشخیصی مولکولی و پژوهشهای ژنتیکی مدرن را شکل داده است.
اهمیت PCR در پزشکی معاصر به ویژه از آن جهت اهمیت دارد که این روش قادر است تغییرات ژنتیکی، عوامل عفونی و نشانگرهای مولکولی را با حساسیتی بسیار بالا شناسایی کند؛ حتی زمانی که مقدار ماده ژنتیکی موجود در نمونه به شدت محدود است. چنین قابلیتی موجب شده PCR به یکی از ابزارهای کلیدی در تشخیص زودهنگام بیماریها، پایش پاسخ به درمان و مدیریت بحرانهای سلامت عمومی تبدیل شود.
تعریف PCR
واکنش زنجیره پلیمراز یک روش آزمایشگاهی مبتنی بر آنزیم است که برای تکثیر نمایی یک توالی مشخص از DNA در محیط خارج از سلول (in vitro) به کار میرود. این روش با استفاده از چرخههای متوالی دمایی و فعالیت آنزیم DNA پلیمراز، امکان سنتز مکرر رشتههای مکمل DNA را فراهم میسازد.
از منظر مفهومی، PCR تقلیدی کنترل شده از همان فرایندی است که در سلولها طی همانندسازی DNA رخ میدهد، با این تفاوت که در PCR، تمامی مراحل در شرایط مصنوعی و تحت نظارت دقیق پژوهشگر انجام میشود.
نکات مهم در تعریف واکنش زنجیره پلیمراز عبارتاند از:
- PCR یک فرایند وابسته به توالی است و تنها قطعاتی از DNA که توسط آغازگرها (Primers) شناسایی میشوند، تکثیر خواهند شد.
- واکنش PCR نیازمند کنترل دقیق دماست و به همین دلیل بدون دستگاه ترموسایکلر (Thermal Cycler) قابل اجرا نیست.
- استفاده از DNA پلیمراز مقاوم به حرارت (مانند Taq polymerase) مرحلهای مهم در انجام واکنش PCR است.
- ماهیت نمایی PCR باعث میشود حتی مقدار بسیار اندک DNA اولیه بهسرعت به مقادیر قابل اندازهگیری افزایش یابد.
اجزای واکنش زنجیره پلیمراز
در انجام این واکنش اجزای زیر مورد استفاده قرار میگیرند:
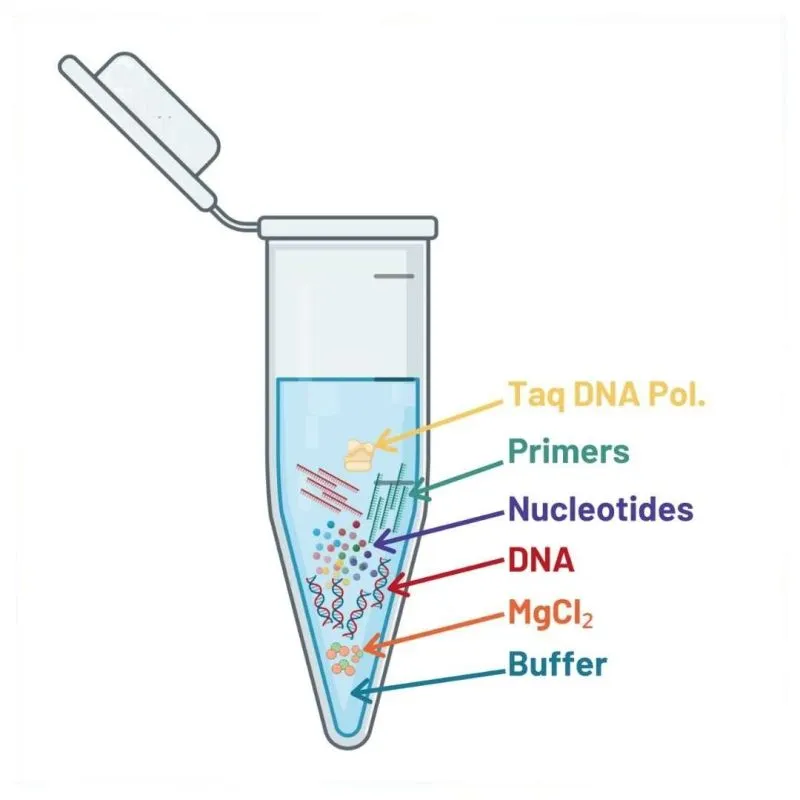
۱. الگوی اسید نوکلئیک (DNA الگو)
DNA الگو، حاوی توالی اسید نوکلئیک انتخاب شدهای است که باید تکثیر شود. در این واکنش الگو باید فقط DNA باشد: DNA ژنومی (gDNA)، DNA مکمل (cDNA) و DNA پلاسمید. واکنش زنجیرهای پلیمراز رونویسی معکوس (RT-PCR) از RNAها به عنوان مواد اولیه استفاده میکند، اما RNAها در درجه اول قبل از تکثیر به DNA مکمل (cDNA) تبدیل میشوند. DNA الگو باید بسیار خالص با نسبت جذب حدود 1.8 باشد. میزان DNA الگو، از مقدار 0.1 تا 200 میکروگرم (با مقدار ایدهآل 30 میکروگرم تا 50 میکروگرم) مورد استفاده قرار میگیرد.
۲. DNA پلیمراز
DNA پلیمرازها آنزیمهایی هستند که سنتز رشتههای DNA مکمل را با مونتاژ متوالی نوکلئوتیدها براساس رشته الگو کاتالیز میکنند، از این رو نقش کلیدی در تکثیر DNA ایفا میکند. آنزیم DNA پلیمراز Taq، آنزیم DNA پلیمراز استخراج شده از باکتری Thermus aquaticus، گستردهترین و شناختهشدهترین DNA پلیمراز مورد استفاده در PCR است. این پلیمراز، از نظر حرارتی پایدار است و پس از چرخه گرمایش و سرمایش مکرر، فعالیت خود را ادامه میدهد. این آنزیم تا دمای 95 درجه سانتیگراد پایدار است و موثرترین واکنش را در دمای حدود 72 تا 78 درجه سانتیگراد با حدود 60 باز در ثانیه نشان میدهد. در یک مخلوط واکنش 50 لیتری، حدود 1 تا 2 واحد Taq پلیمراز برای تکثیر کافی است. دو آنزیم DNA پلیمراز مقاوم به حرارت دیگر نیز شناسایی شدهاند که با نامهای آنزیم Vent جدا شده از Thermococcus litoralis و آنزیم Pfu جدا شده از Pyrococcus furiosus شناخته میشوند.
۳. آغازگرها
پرایمرها، توالیهای تکرشتهای کوتاه الیگونوکلئوتیدی هستند که به صورت مصنوعی سنتز میشوند و مکمل توالی اسید نوکلئیک هدف در DNA الگو هستند. آنها توالیهای کوتاهی با حدود ۱۵ تا ۳۰ باز هستند که به عنوان نقطه شروع سنتز DNA عمل میکنند. پرایمرها در موقعیت مکمل خود در یک رشته DNA الگو تکرشتهای به هم متصل میشوند. سپس آنزیم DNA پلیمراز این آغازگر را از انتهای OH-3 آن امتداد میدهد و یک رشته مکمل جدید تشکیل میدهد. معمولاً ۱۰ تا ۱۲ پیکومول از هر آغازگر برای واکنش PCR کافی است.
آغازگرهای PCR دو نوع هستند؛ آغازگرهای رو به جلو و معکوس (forward and reverse primers). آغازگرهای رو به جلو مکمل رشته آنتیسنس (رشته الگو از جهت ۳’ به ۵’) و مسئول تکثیر رشته آنتیسنس هستند. به این پرایمرها، آغازگرهای ۵’ نیز میگویند. آغازگرهای معکوس مکمل رشته سنس (رشته الگو از جهت ۵’ به ۳’) و مسئول تکثیر رشته سنس هستند. به آنها پرایمر 3′ نیز گفته میشود.
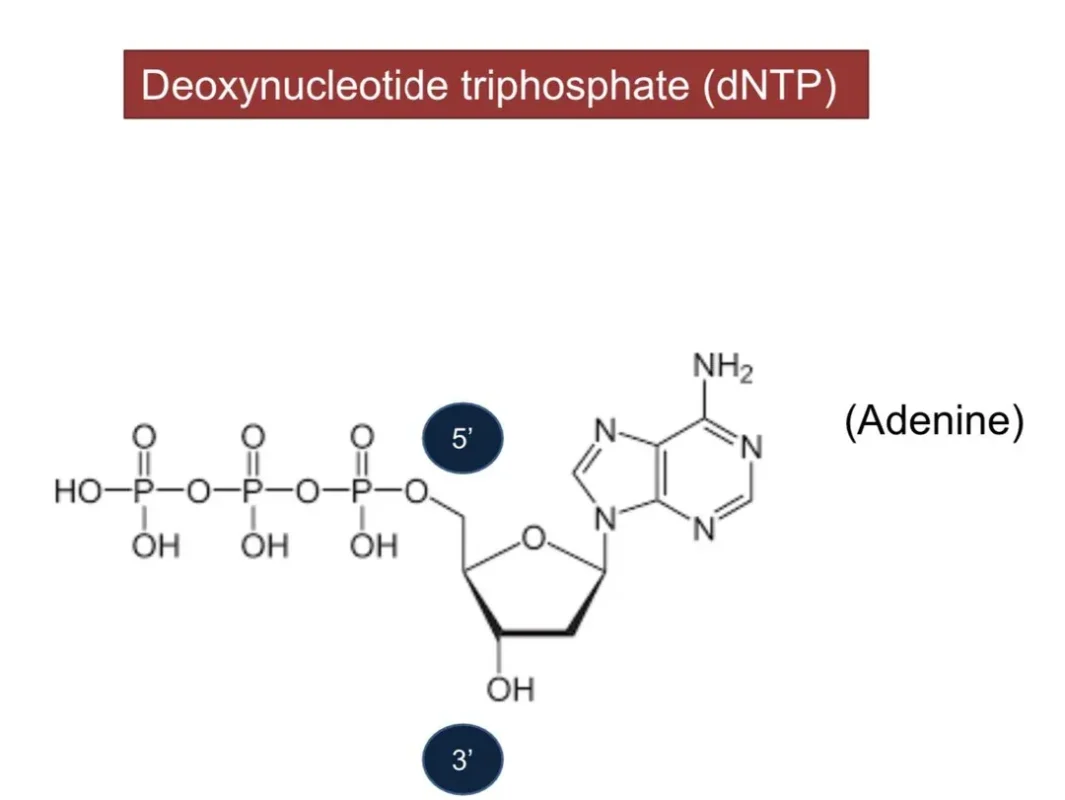
۴. نوکلئوتیدها (دئوکسی نوکلئوتید تری فسفاتها)
دئوکسی نوکلئوتید تری فسفاتها (dNTPها) نوکلئوتیدهایی هستند که به صورت مصنوعی سنتز میشوند و به عنوان بلوکهای سازنده رشتههای DNA جدید عمل میکنند. 4 dNTP مختلف در PCR مورد استفاده قرار میگیرند؛ دئوکسی آدنوزین تری فسفات (dATP)، دئوکسی گوانوزین تری فسفات (dGTP)، دئوکسی تیمیدین تری فسفات (dTTP) و دئوکسی سیتیدین تری فسفات (dCTP). چهار نوع dNTP بهصورت متوالی و مطابق با توالی رشتهی الگو، توسط DNA پلیمراز یکییکی به انتهای 3′ پرایمر اضافه میشوند و رشتهٔ جدیدی از DNA را مکمل رشتهی الگو میسازند.
۵. بافرهای PCR و سایر مواد شیمیایی
کل فرآیند باید در یک سیستم بافر مبتنی بر Tris-HCl با pH (۸تا ۹.۵) انجام شود. سیستم بافری رایج مورد استفاده، یک بافر 10X با MgCl2 اضافی است. اجزای رایج بافرهای PCR شامل دی متیل سولفوکسید (DMSO)، سولفات آمونیوم ((NH4)2SO4)، شویندههای غیر یونی، پلی اتیلن گلیکون (PEG)، N،N،N-تری متیل گلیسین، کلرید پتاسیم (KCl)، کلرید منیزیم (MgCl2)، تترا متیل آمونیوم کلرید، تریس-HCl، اتیلن دی آمین تترا استیک اسید (EDTA)، 7-دآزا-2′-دئوکسی گوانوزین 5′-تری فسفات، گلیسرول، فرمامید، آلبومین سرم و غیره هستند. سیستم بافری، کارایی و اختصاصیت واکنش را افزایش میدهد و از مهار و تشکیل ساختار ثانویه در طول فرآیند جلوگیری میکند.
۶. ترموسایکلر
ترموسایکلر که با نام دستگاه PCR نیز شناخته میشود، یک دستگاه گرمایشی الکتریکی است که دما را در هر مرحله از فرآیند PCR با توجه به شرایط و نیاز واکنش تنظیم میکند. این دستگاه دما را در مرحله دناتوراسیون افزایش میدهد و در طول اتصال آن را کاهش میدهد و دوباره در طول مرحله طویلسازی دما را افزایش میدهد. این فرآیند افزایش و کاهش دما به صورت چرخهای و طبق تنظیمات از پیش برنامهریزی شده یا دستورالعمل کاربر قبل از شروع به کار، رخ میدهد.

مکانیسم مولکولی PCR
فرایند واکنش زنجیره پلیمراز بر پایه تکرار چرخههای حرارتی طراحی شده است که هر چرخه منجر به دو برابر شدن تعداد نسخههای DNA هدف میشود. این چرخهها شامل سه مرحله اصلی هستند که بهصورت متوالی تکرار میشوند. در ادامه به معرفی هر یک مراحل PCR میپردازیم:
مراحل PCR
واکنش زنجیره پلیمراز از سه مرحله دناتوراسیون، اتصال و گسترش تشکیل میشود که در این بخش هر یک را مورد بررسی قرار میدهیم:
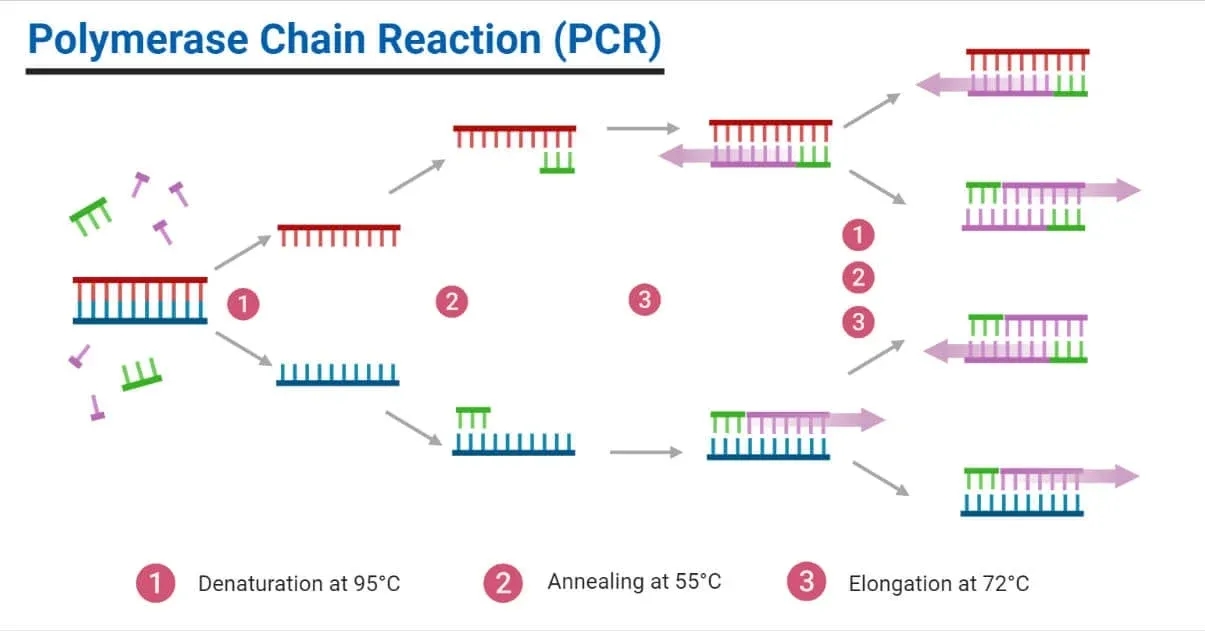
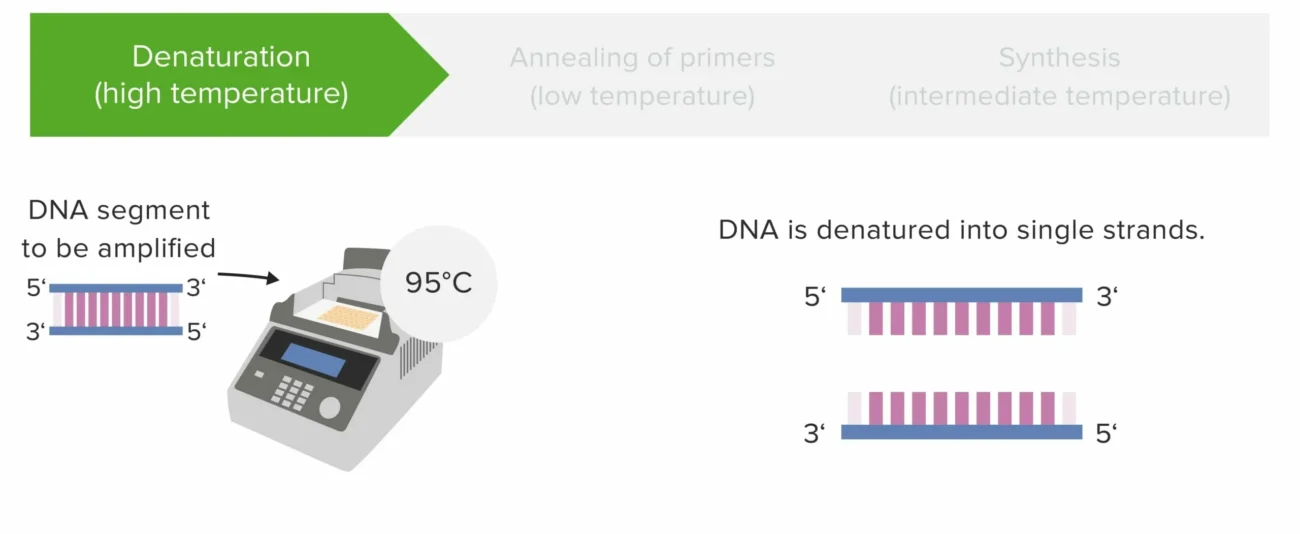
دناتوراسیون (Denaturation)
در مرحله دناتوراسیون، DNA دو رشتهای به دو تک رشته تبدیل میشود. این مرحله برای فراهم کردن دسترسی آغازگرها (پرایمرها) به توالی هدف ضروری است.
ویژگیهای کلیدی این مرحله شامل موارد زیر است:
- دما معمولاً در محدوده ۹۴ تا ۹۶ درجه سانتیگراد تنظیم میشود.
- پیوندهای هیدروژنی بین بازهای مکمل شکسته میشوند.
- مدت زمان دناتوراسیون به طول DNA و میزان تکرارهای GC آن وابسته است.
- مرحله دناتوراسیون اولیه اغلب طولانیتر از چرخههای بعدی است تا جداسازی کامل رشتهها تضمین شود.
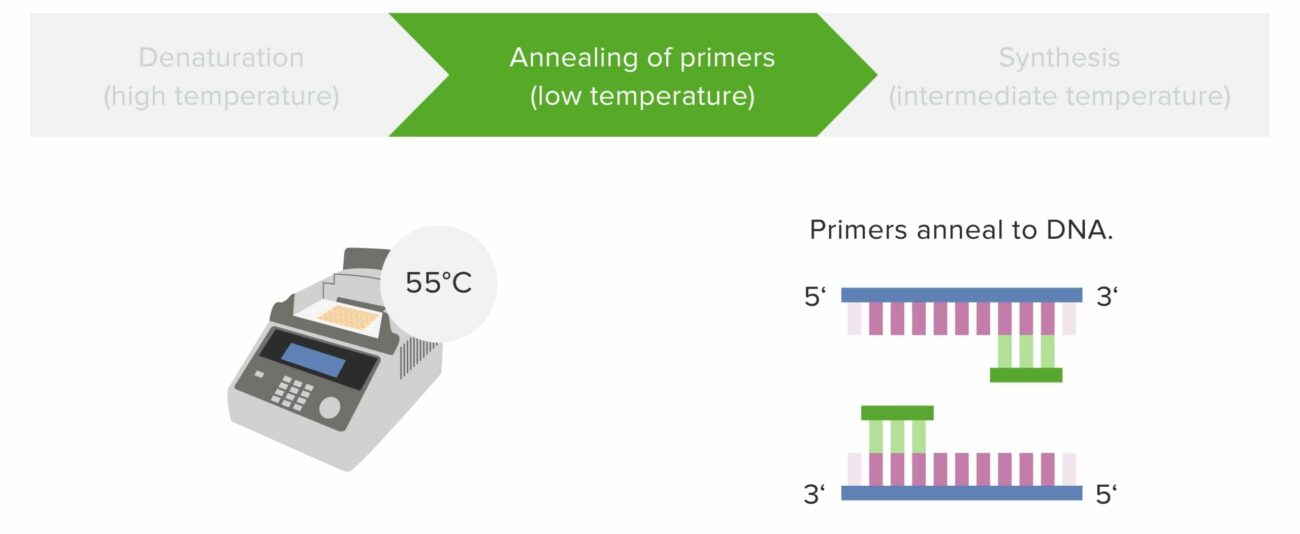
اتصال پرایمرها (Annealing)
پس از دناتوراسیون، دما کاهش مییابد تا آغازگرها بتوانند به توالیهای مکمل خود روی DNA متصل شوند. این مرحله نقش تعیینکنندهای در اختصاصیت PCR دارد.
نکات مهم در مرحله Annealing شامل:
- دمای اتصال معمولاً بین ۵۰ تا ۶۵ درجه سانتیگراد است.
- هر واکنش PCR شامل دو آغازگر (Forward و Reverse) است.
- طراحی نادرست پرایمرها میتواند به تکثیر غیراختصاصی منجر شود.
- بهینهسازی دمای اتصال برای کاهش نویز و افزایش دقت الزامی است.
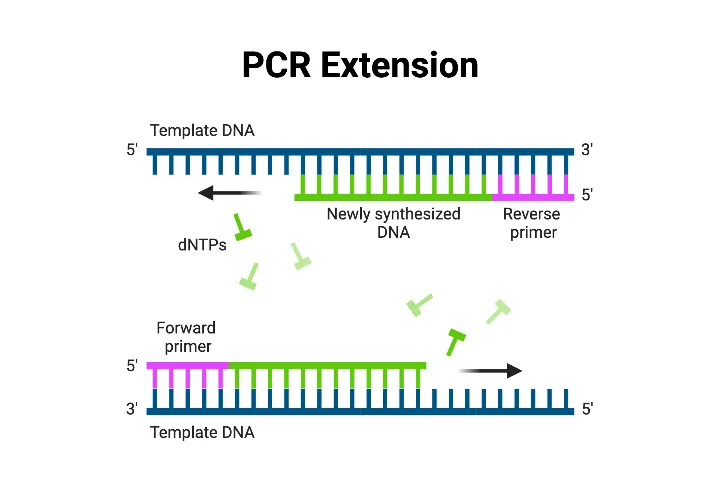
گسترش یا طویلسازی (Extension)
در مرحله طویلسازی، آنزیم DNA پلیمراز (Taq پلیمراز) با افزودن نوکلئوتیدها به انتهای ۳′ آغازگر، رشته جدید DNA را سنتز میکند.
مشخصات این مرحله:
- دمای استاندارد حدود ۷۲ درجه سانتیگراد است.
- سرعت طویلسازی معمولاً حدود ۱ کیلوباز در دقیقه است.
- طول این مرحله به اندازه قطعه هدف بستگی دارد.
- دقت آنزیم پلیمراز بر صحت توالی تکثیر شده اثر مستقیم دارد.
چرخههای PCR و ماهیت نمایی تکثیر
تکرار متوالی مراحل دناتوراسیون، اتصال آغازگرها و طویلسازی، چرخه PCR را تشکیل میدهد. هر چرخه منجر به دو برابر شدن تعداد نسخههای DNA هدف میشود.
ویژگیهای چرخه PCR:
- معمولاً بین ۲۵ تا ۳۵ چرخه در روند PCR اجرا میشود.
- تعداد چرخهها بر حساسیت و اختصاصیت واکنش اثر میگذارد.
- چرخههای بیش از حد میتوانند باعث افزایش محصولات غیراختصاصی شوند.
- در پایان واکنش، میلیونها نسخه از DNA هدف تولید میشود.
کاربردهای PCR
واکنش زنجیرهای پلیمراز طیف گستردهای از کاربردها را در زمینههای مختلف دارد و به طور قابل توجهی بر تحقیقات، تشخیص و فناوریهای پزشکی تأثیر میگذارد. توانایی این واکنش، در تکثیر بخشهای خاصی از DNA، آن را به ابزاری ضروری در زیستشناسی مولکولی تبدیل کرده است. در این بخش به معرفی انواع کاربردهای PCR میپردازیم:
واکنش زنجیره پلیمراز در تشخیص پزشکی
از جملهی کاربردهای مهم PCR در تشخیص پزشکی میتوان به موارد زیر اشاره کرد:
- تشخیص بیماریهای ویروسی مانند COVID-19، HIV و هپاتیتهای ویروسی
- شناسایی عفونتهای باکتریایی و انگلی
- پایش بار ویروسی بیماران در طول درمان
- تشخیص زودهنگام بیماریها پیش از بروز علائم بالینی
- تأیید یا رد نتایج آزمایشهای غربالگری
PCR در پزشکی قانونی (Forensic Medicine)
واکنش زنجیره پلیمراز نقش تعیینکنندهای در پیشرفت پزشکی قانونی ایفا کرده است. توانایی تکثیر DNA از نمونههای بسیار کوچک، امکان تحلیل ژنتیکی شواهد محدود را فراهم ساخته است.

کاربردهای PCR در پزشکی قانونی شامل موارد زیر است:
- شناسایی هویت افراد از طریق DNA profiling
- تحلیل نمونههای تخریبشده یا بسیار اندک
- بررسی نسبتهای خویشاوندی
- استفاده در تحلیل STR (Short Tandem Repeats)
- افزایش دقت و قطعیت در پروندههای جنایی
نقش واکنش زنجیره پلیمراز در تحقیقات ژنتیکی و زیستمولکولی
PCR ابزار اصلی بسیاری از پژوهشهای پایه و کاربردی در زیستشناسی مولکولی به شمار میآید و بدون آن بخش قابل توجهی از تحقیقات ژنتیکی امکانپذیر نخواهد بود.
کاربردهای تحقیقاتی PCR:
- بررسی بیان ژنها با استفاده از RT-PCR (Reverse Transcription PCR)
- شناسایی جهشها، پلیمورفیسمها و تغییرات ژنتیکی
- کلونینگ ژنها و ساخت وکتورهای نوترکیب
- مطالعات اپیژنتیک و تنظیم بیان ژن
- مهندسی ژنتیک و زیستفناوری
PCR و پزشکی شخصیسازیشده (Personalized Medicine)
پزشکی نوین بهطور فزایندهای به سمت درمانهای فردمحور حرکت کرده است و PCR یکی از ابزارهای کلیدی این تحول محسوب میشود.
نقش PCR در پزشکی شخصیسازیشده:
- شناسایی بیومارکرهای مولکولی اختصاصی هر بیمار
- انتخاب درمانهای هدفمند براساس ویژگیهای ژنتیکی
- پایش پاسخ بیمار به درمان
- تشخیص مقاومت دارویی
- استفاده در liquid biopsy برای شناسایی جهشهای سرطانی
کاربردهای واکنش زنجیره پلیمراز در محیط زیست و کشاورزی
PCR تنها به حوزه پزشکی محدود نمیشود و در علوم محیط زیست و کشاورزی نیز کاربردهای گستردهای دارد.
مهمترین کاربردها:
- شناسایی موجودات تراریخته (GMOs)
- بررسی تنوع زیستی و اکولوژیک
- پایش میکروارگانیسمهای محیطی
- تشخیص پاتوژنهای گیاهی
- کنترل کیفیت محصولات کشاورزی
مزایای واکنش زنجیرهای پلیمراز
PCR به دلیل مجموعهای از ویژگیهای فنی و عملی، به یکی از پرکاربردترین و غیرقابلجایگزینترین تکنیکها در زیستشناسی مولکولی و پزشکی تشخیصی تبدیل شده است. این مزایا موجب شدهاند PCR هم در پژوهشهای پایه و هم در کاربردهای بالینی، جایگاه ویژهای داشته باشد.
از جمله مهمترین مزایای PCR میتوان به موارد زیر اشاره کرد:
حساسیت و اختصاصیت بسیار بالا:
با استفاده از تکنیک PCR میتوان حتی یک نسخه از DNA هدف را شناسایی و به میلیونها نسخه تکثیر کرد. این حساسیت بالا، امکان تشخیص اهداف با فراوانی ناچیز را در نمونههای پیچیده فراهم میسازد. از طرفی دیگر اختصاصیت پرایمرهای مورد استفاده در PCR باعث میشود، تنها توالی مورد نظر تکثیر شود؛ این ویژگی در تشخیص عوامل بیماریزا و آزمایشهای ژنتیکی اهمیت حیاتی دارد.
سرعت بالای انجام واکنش:
فرایند PCR از استخراج اسید نوکلئیک تا تکثیر، معمولاً در چند ساعت قابل انجام است. این زمان کوتاه پاسخدهی، PCR را به ابزاری بسیار ارزشمند در تشخیصهای بالینی تبدیل کرده است، زیرا تصمیمگیری درمانی موثر به نتایج سریع و دقیق وابسته است.
انعطافپذیری و گستره وسیع کاربردها:
PCR قابلیت تطبیق با اهداف متنوع را دارد و میتواند برای کاربردهایی مانند بررسی بیان ژن (qPCR)، مطالعه RNA (RT-PCR) و تحلیل اهداف متعدد بهطور همزمان به کار رود. توسعه روشهایی مانند PCR دیجیتال (dPCR) و High-Throughput PCR نیز دامنه کاربرد این تکنیک را به طور چشمگیری گسترش داده است.
با توسعه کیتهای استاندارد و تجهیزات کاربرپسند، PCR به تکنیکی قابل اجرا در اغلب آزمایشگاهها تبدیل شده است. نیاز به تعداد محدودی از اجزای اصلی و سادگی نسبی پروتکلها، اجرای این روش را حتی در آزمایشگاههای کوچک امکانپذیر کرده است.
پویایی فناورانه و نوآوری مستمر:
PCR همچنان در حال تکامل است و نوآوریهایی مانند دستگاههای PCR قابل حمل (Point-of-Care PCR) امکان تشخیص سریع و میدانی را فراهم کردهاند. این روند توسعه، جایگاه PCR را به عنوان یکی از ارکان اصلی زیستشناسی مولکولی و پزشکی مدرن تثبیت کرده است.
محدودیتهای واکنش زنجیرهای پلیمراز
با وجود کاربرد گسترده و مزایای قابلتوجه، تکنیک PCR با محدودیتهایی همراه است که میتوانند بر دقت، قابلیت اعتماد و تفسیر نتایج آن در محیطهای پژوهشی و بالینی تأثیر بگذارند. برای استفاده دقیق و صحیح از PCR شناخت این چالشها اهمیت بالایی دارد. در ادامه به بررسی این محدودیتها میپردازیم:
حساسیت به آلودگی و کاهش اختصاصیت:
PCR بهدلیل توانایی تکثیر بسیار بالا، به آلودگیهای جزئی نیز حساس است و ورود DNA غیرهدف میتواند منجر به ایجاد نتایج مثبت کاذب شود. علاوه بر این، عدم تطابق کامل آغازگرها با توالی هدف ممکن است اختصاصیت واکنش را کاهش داده و نتایج نادرست ایجاد کند.
پوشش محدود سویهها و خطر منفی کاذب:
بسیاری از آزمونهای PCR بر پایهی شناسایی توالیهای ژنتیکی مشخص طراحی میشوند، از اینرو، ممکن است توانایی تشخیص تمامی سویهها یا واریانتهای ژنتیکی یک پاتوژن را نداشته باشند. این مسئله به ویژه در مورد عوامل عفونی نوظهور، جهشیافته یا کمیاب اهمیت مییابد، زیرا میتواند منجر به بروز نتایج منفی کاذب شود. بروز این چالشها در تشخیص بالینی، پایش اپیدمیولوژیک و انتخاب روشهای درمانی پیامدهای قابلتوجهی به همراه دارد.
پیچیدگی بهینهسازی و وابستگی به مهارت فنی:
اجرای موفق PCR نیازمند بهینهسازی دقیق پارامترهایی مانند طراحی پرایمرها، دمای اتصال و شرایط واکنش است. این پیچیدگی، دستیابی به نتایج پایدار و قابل تکرار را در آزمایشگاههای فاقد نیروی متخصص دشوار میسازد.
وابستگی به تجهیزات و منابع آزمایشگاهی:
انجام واکنش زنجیره پلیمراز مستلزم دسترسی به تجهیزات تخصصی مانند ترموسایکلر و مواد مصرفی خاص است که در برخی محیطها، به ویژه مناطق کمبرخوردار، بهسادگی در دسترس نیست و میتواند هزینهبر باشد.
چالشهای تفسیر نتایج، به ویژه در روشهای کمی:
تفسیر نتایج PCR، به خصوص در روشهای کمی مانند qPCR و PCR دیجیتال، نیازمند دانش آماری و ابزارهای تحلیلی پیشرفته است. تفسیر نادرست دادهها میتواند منجر به تصمیمگیریهای نادرست پژوهشی یا بالینی شود.
انواع PCR
با گذشت زمان و گسترش نیازهای تحقیقاتی و بالینی، واکنش زنجیرهای پلیمراز از شکل کلاسیک اولیه خود فراتر رفته و به مجموعهای از فناوریها تبدیل شده است. هر یک از این نسخهها، با هدف رفع محدودیتهای PCR کلاسیک یا پاسخ به نیازهای خاصی مانند کمیسازی، افزایش حساسیت، یا امکان تشخیص همزمان چند هدف طراحی شدهاند. این تکامل فناوری، PCR را به یکی از انعطافپذیرترین ابزارهای زیستمولکولی تبدیل کرده است. در ادامه به معرفی مهمترین انواع PCR میپردازیم:
PCR رونویسی معکوس (RT-PCR)
تکنیکPCR رونویسی معکوس یا RT-PCR (Reverse Transcription PCR) یکی از بنیادیترین و پرکاربردترین انواع PCR به شمار میآید که امکان مطالعه RNA را فراهم میکند. از آنجا که آنزیم DNA پلیمراز تنها قادر به تکثیر DNA است، در این روش ابتدا RNA به DNA مکمل (Complementary DNA یا cDNA) تبدیل میشود.
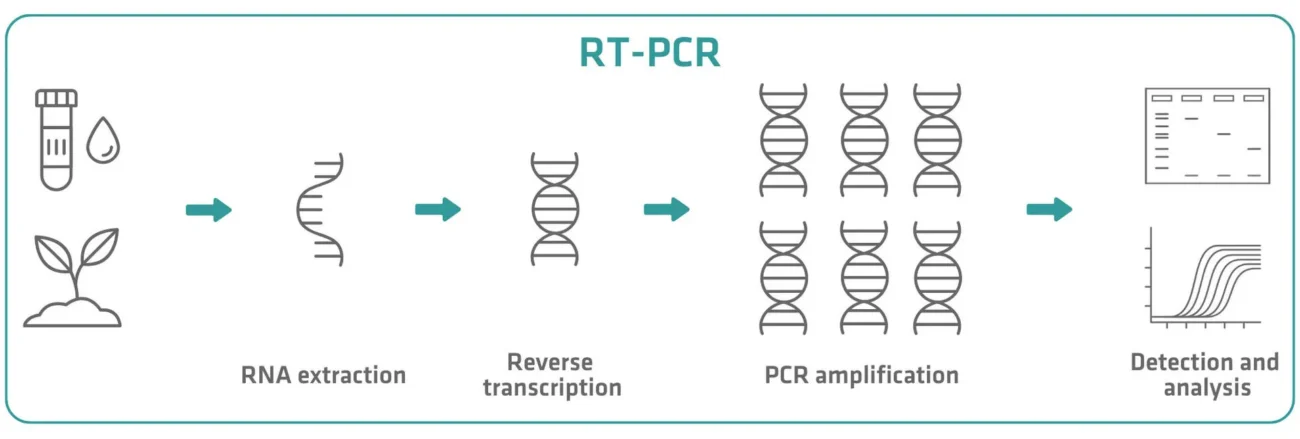
نکات مهم در تکنیک RT-PCR:
- مرحله اول این واکنش، شامل استفاده از آنزیم رونوشتبردار معکوس (Reverse Transcriptase) برای تبدیل RNA به cDNA است.
- RT-PCR ابزار اصلی بررسی بیان ژنها در سلولها و بافتها محسوب میشود.
- این روش در تشخیص ویروسهای RNAدار مانند SARS-CoV-2، HIV و ویروس آنفلوانزا نقش کلیدی دارد.
- دقت RT-PCR به کیفیت RNA اولیه وابستگی بالایی دارد.
- تخریب RNA یا آلودگی RNase میتواند نتایج را بهشدت تحت تأثیر قرار دهد.
PCR کمی ( Real-Time PCR)
PCR کمی (Quantitative PCR; qPCR) یا Real-Time PCR تحولی اساسی در استفاده تشخیصی و پژوهشی از PCR ایجاد کرده است. در این روش، فرایند تکثیر DNA بهصورت همزمان و در طول چرخهها پایش میشود.
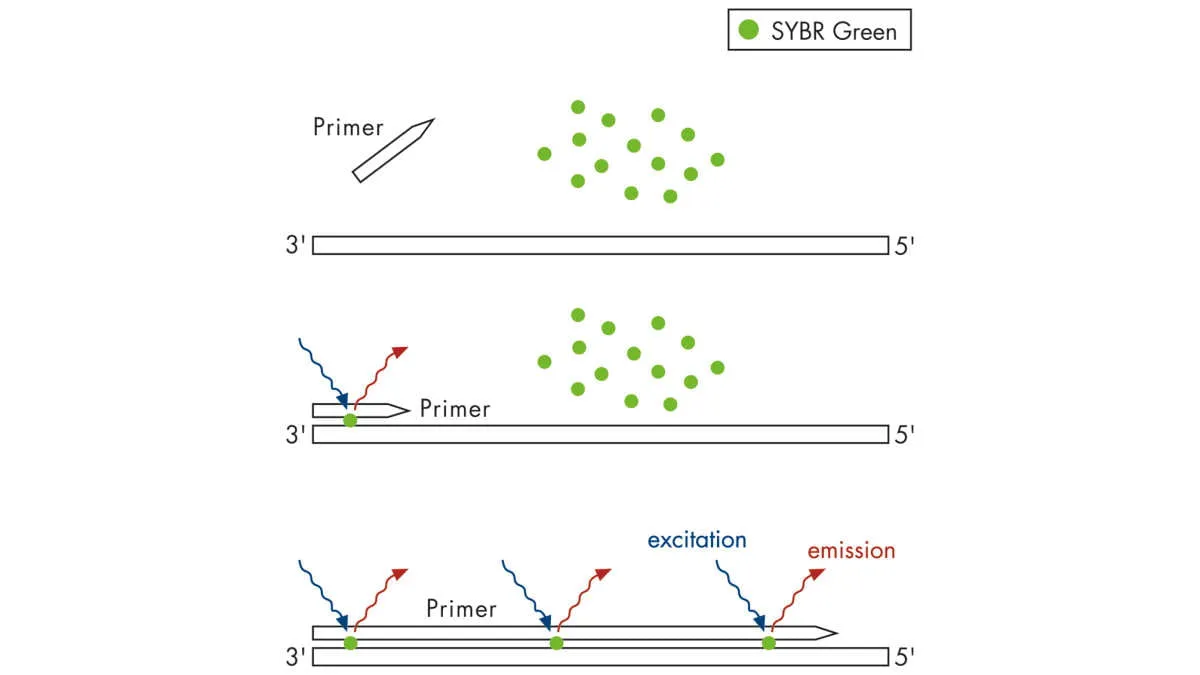
ویژگیها و مزایای qPCR شامل موارد زیر است:
- استفاده از رنگهای فلورسنت یا پروبهای اختصاصی برای پایش تولید DNA
- امکان اندازهگیری مقدار اولیه اسید نوکلئیک در نمونه
- کاربرد گسترده در اندازهگیری بار ویروسی و بار باکتریایی
- استفاده وسیع در مطالعات بیان ژن و مقایسه سطوح بیان
- دقت بالا اما وابسته به طراحی صحیح پرایمر و پروب
- PCR دیجیتال (Digital PCR)
PCR دیجیتال (dPCR) یکی از پیشرفتهترین نسخههای PCR است که با تقسیم نمونه به هزاران یا میلیونها واکنش مستقل، امکان اندازهگیری مطلق تعداد مولکولهای DNA یا RNA را فراهم میکند.
ویژگیهای متمایز dPCR:
- عدم نیاز به منحنی استاندارد برای کمیسازی
- حساسیت بسیار بالا در شناسایی توالیهایی با فراوانی کم
- توانایی تشخیص جهشهای نادر (Rare Mutations)
- کاربرد ویژه در انکولوژی مولکولی و liquid biopsy
- هزینه و پیچیدگی بالاتر نسبت به qPCR
PCR چندگانه (Multiplex PCR)
Multiplex PCR امکان تکثیر همزمان چند توالی هدف را در یک واکنش فراهم میکند. این ویژگی به خصوص در تشخیصهای بالینی اهمیت بالایی دارد.
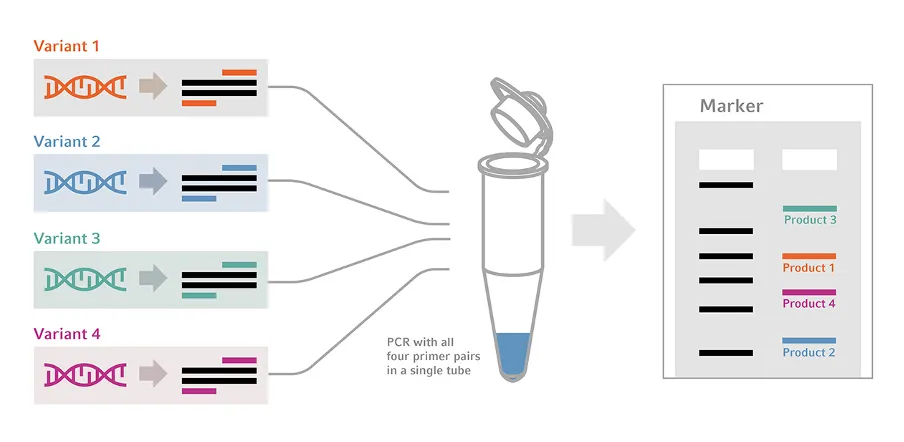
نکات کلیدی Multiplex PCR:
- استفاده همزمان از چند جفت آغازگر در یک واکنش
- کاهش زمان، هزینه و حجم نمونه مورد نیاز
- کاربرد گسترده در پنلهای تشخیص عفونتهای تنفسی و گوارشی
- طراحی پیچیدهتر پرایمرها برای جلوگیری از تداخل
- نیاز به بهینهسازی دقیق شرایط واکنش
اجرای واکنش زنجیرهای پلیمراز در مقیاس بالا (High-Throughput PCR)
High-Throughput PCR برای پاسخ به نیازهای آزمایشگاههایی که با حجم بالایی از نمونهها سروکار دارند، مانند آزمایشگاههای تشخیص مرجع و مراکز اپیدمیولوژی طراحی شده است.
ویژگیهای این روش:
- پردازش همزمان صدها تا هزاران نمونه
- اتوماسیون گسترده فرایندها
- کاهش خطای انسانی
- کاربرد وسیع در غربالگریهای جمعیتی
- نیازمند تجهیزات پیشرفته و زیرساخت مناسب
سامانههای PCR قابلحمل برای تشخیص سریع (Point-of-Care PCR)
Point-of-Care PCR یکی از مهمترین نوآوریهای اخیر در حوزه تشخیص سریع است. این سیستمها امکان انجام PCR را خارج از آزمایشگاههای مرکزی فراهم میکنند.
کاربردها و ویژگیها:
- دستگاههای قابل حمل و کوچک
- زمان پاسخ کوتاه (گاهی کمتر از یک ساعت)
- مناسب برای مناطق کمبرخوردار یا شرایط بحرانی
- نقش حیاتی در مدیریت همهگیریها
- حساسیت کمی پایینتر نسبت به سیستمهای آزمایشگاهی پیشرفته
Overlap Extension PCR (PCR با گسترش همپوشان)
Overlap Extension PCR یک روش تخصصی در مهندسی ژنتیک است که برای اتصال چند قطعه DNA بدون استفاده از آنزیمهای محدودکننده به کار میرود.
ویژگیهای این روش:
- اتصال دقیق و بدون درز قطعات DNA
- کاربرد در ساخت ژنهای نوترکیب
- استفاده گسترده در زیستفناوری و زیستشناسی مصنوعی
- نیازمند طراحی بسیار دقیق توالیهای همپوشان
- حساس به خطاهای طراحی پرایمر
مسیرهای نوآوری و توسعه آینده PCR
تحقیقات در حال انجام در حوزه واکنش زنجیره پلیمراز بر بهبود دقت، کاهش خطا و افزایش دسترسپذیری این تکنیک متمرکز است. ادغام PCR با فناوریهای میکروفلوئیدیک، سیستمهای خودکار و تحلیلهای مبتنی بر هوش مصنوعی، افقهای جدیدی برای این تکنیک گشوده است.
روندهای آیندهی این روش شامل موارد زیر است:
- یکپارچهسازی واکنش زنجیره پلیمراز با سامانههای تشخیص هوشمند
- کاهش وابستگی به زیرساختهای آزمایشگاهی سنگین
- افزایش کاربردهای بالینی در محل مراقبت بیمار
- ترکیب PCR با فناوریهای توالییابی
- توسعه سیستمهای کاملاً خودکار و بسته
خلاصه مطلب
واکنش زنجیرهای پلیمراز یکی از ستونهای اصلی زیستشناسی مولکولی و پزشکی تشخیصی مدرن است. توانایی این تکنیک در تکثیر دقیق و سریع DNA، آن را به ابزاری غیرقابل جایگزین در پژوهش، تشخیص و سلامت عمومی تبدیل کرده است. با وجود چالشها و محدودیتها، PCR همچنان نقش محوری خود را حفظ کرده و در آینده نیز بهعنوان یکی از پایههای اصلی پزشکی و علوم زیستی باقی خواهد ماند.
منبع: sciencelearn ، yourgenome، microbenotes، mybiosource

