روندهای نوین پاتولوژی مولکولی: تحول دیجیتال، هوش مصنوعی و آینده تشخیص

پاتولوژی مولکولی طی دو دهه اخیر به یکی از بنیانهای اصلی تشخیص دقیق (Precision Diagnostics) تبدیل شده است و نقش آن در انکولوژی، بیماریهای ژنتیکی و پزشکی شخصیسازیشده به طور چشمگیری گسترش یافته است. در سالهای اخیر، ظهور فناوریهایی مانند Whole Slide Imaging (WSI)، پاتولوژی دیجیتال، هوش مصنوعی (AI) و مدلهای چندوجهی که دادههای مولکولی و مورفولوژیک را ترکیب میکنند، افق جدیدی در تفسیر بافتها و شناسایی بیومارکرها ایجاد کرده است.اگرچه پاتولوژی مولکولی و پاتولوژی دیجیتال دو حوزه مستقل محسوب میشوند، اما در پزشکی مدرن بهصورت مکمل عمل میکنند و ارزش واقعی آنها در ادغام دادههای مولکولی و مورفولوژیک نمایان میشود.
مطالعات متعدد منتشرشده در PubMed، Nature Medicine و Modern Pathology نشان میدهند که مدلهای مبتنی بر هوش مصنوعی در تحلیل اسلایدهای دیجیتال میتوانند به دقتی نزدیک به پاتولوژیستهای با تجربه برسند و در برخی کاربردها حساسیتی بالاتر از ۹۵٪ ارائه دهند.
با پیشرفت فناوریهای توالییابی نسل جدید (NGS)، امکان شناسایی دقیقتر جهشهای ژنتیکی، امضاهای مولکولی و الگوهای بیان ژنی فراهم شده است. بسیاری از این یافتههای مولکولی با ویژگیهای بافتی قابل مشاهده در اسلایدهای میکروسکوپی ارتباط قابلتوجهی دارند و این ارتباط روزبهروز مستحکمتر میشود. این همگرایی میان دادههای مولکولی و تصویری باعث شده است پاتولوژی مولکولی وارد مرحلهای نوین شود؛ مرحلهای که در آن تشخیص نه تنها سریعتر و دقیقتر انجام میشود، بلکه توانایی پیشبینی رفتار تومور و انتخاب درمان مناسب نیز بهطور چشمگیری افزایش یافته است.
تاریخچه و اهمیت بالینی پاتولوژی مولکولی
پاتولوژی مولکولی در دهه ۱۹۸۰، همزمان با گسترش روشهایی مانند PCR و هیبریداسیون DNA، جایگاه خود را بهعنوان یک شاخه نوظهور تثبیت کرد. در آن زمان، هدف اصلی این حوزه شناسایی جهشهای ژنتیکی مرتبط با سندرمهای ارثی و برخی سرطانها بود. با این حال، با پیشرفت توالییابی Sanger و سپس ظهور NGS، دامنه کاربردها بهطور چشمگیری گسترش یافت:
- طبقهبندی مولکولی تومورها
- انتخاب درمانهای هدفمند
- پایش حداقل باقیمانده بیماری (MRD)
- پیشبینی پاسخ به درمان
- ارزیابی خطر و پیشآگهی مبتنی بر امضاهای ژنومی
امروزه، راهنماهای معتبر مانند CAP، WHO، NCCN بهطور رسمی تأکید میکنند که تشخیص بسیاری از سرطانها بدون ارزیابی مولکولی ناقص است. مطالعات معتبر پزشکی نشان میدهند که در سرطان ریه، کولورکتال، ملانوما و پستان، بیش از ۵۰٪ تصمیمات درمانی وابسته به نتایج تستهای مولکولی است. همین واقعیت باعث شد که پاتولوژی مولکولی از یک «روش کمکی» به «محرک اصلی تصمیمسازی درمان» تبدیل شود.
پاتولوژی دیجیتال و Whole Slide Imaging (WSI)
پاتولوژی دیجیتال امروزه به مهمترین فناوری تحولآفرین در پاتولوژی مدرن تبدیل شده است. تصویربرداری کامل اسلاید یا WSI امکان اسکن و دیجیتالیسازی کل اسلاید را با رزولوشن میکروسکوپی فراهم میکند. این تصاویر دیجیتال مزیتهایی ارائه میدهند که در پاتولوژی سنتی ممکن نبود:
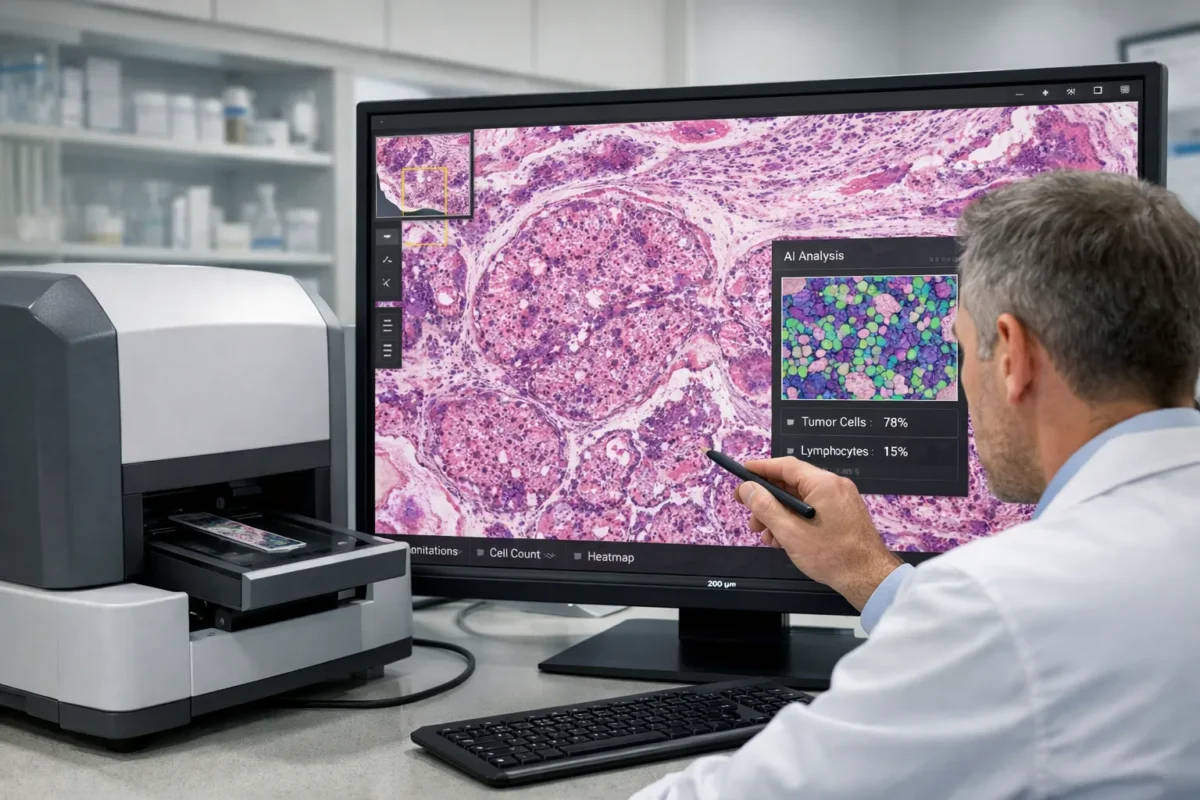
- مشاهده و تشخیص از راه دور
- اشتراکگذاری سریع برای مشاوره
- آرشیو ایمن و بلندمدت بدون کاهش کیفیت
- تحلیل کمی (Quantitative Pathology)
- کاربرد در آموزش، پژوهش و مدلسازی
- ادغام با مدلهای هوش مصنوعی
مطالعات معتبر در این زمینه نشان میدهند که طی پنج سال گذشته، استفاده از WSI در مراکز دانشگاهی تا دو برابر افزایش یافته است و بسیاری از بیمارستانها اکنون از آن برای موارد تشخیصی اولیه نیز استفاده میکنند.
کاربردهای عملی WSI در آزمایشگاههای مدرن
در آزمایشگاههای پیشرفتهی پاتولوژی، WSI امروزه نقشی کاملاً عملی دارد:
- آموزش ساختاریافته: امکان ایجاد بانکهای دیجیتال برای آموزش رزیدنتها
- تلهپاتولوژی: ارائه نظر دوم از راه دور بدون ارسال فیزیکی اسلاید
- تحلیل کمی: اندازهگیریهای خودکار مانند Tumor Burden
- مطالعات چندمرکزی: همترازی استاندارد اسلایدها برای پژوهش
چالشهای استانداردسازی
اگرچه مزایای WSI فراوان است، چالشهایی نیز وجود دارد که در منابع معتبر به آنها اشاره شده است:
- تفاوت رزولوشن و کیفیت اسکنرها
- Variability رنگ و نیاز به استاندارد رنگ
- حجم بسیار زیاد داده (گاهی تا ۳ گیگابایت برای یک اسلاید)
- نیاز به مدیریت امنیت داده و حریم خصوصی بیمار
این چالشها نشان میدهند که دیجیتالسازی موفق آزمایشگاههای پاتولوژی نیازمند زیرساخت، آموزش و چارچوبهای دقیق کنترل کیفیت است.
نقش هوش مصنوعی در دگرگونی پاتولوژی مولکولی
هوش مصنوعی (AI) طی سالهای اخیر به یکی از نیروهای محرک اصلی تحول در پاتولوژی دیجیتال و بهویژه پاتولوژی مولکولی تبدیل شده است. مدلهای یادگیری عمیق نهتنها ویژگیهای قابل مشاهده، بلکه الگوهای پنهانی را نیز تحلیل میکنند که چشم انسان قادر به تشخیص آنها نیست. این مدلها جایگزین تستهای مولکولی استاندارد نیستند، بلکه بهعنوان ابزار کمکی برای غربالگری، اولویتبندی و تصمیمسازی استفاده میشوند
تواناییهای کلیدی AI در پاتولوژی دیجیتال
مطالعات معتبر در این زمینه نشان میدهند AI قادر به انجام موارد زیر است:
- طبقهبندی تومورها با دقت بالاتر از ۹۰٪
- تشخیص سلولهای بدخیم حتی در نمونههای کمسلول
- پیشبینی جهشهای مهم مولکولی مانند EGFR، KRAS، BRAF
- تخمین MSI-H و TMB از تصاویر H&E
- پیشبینی پاسخ به ایمنوتراپی
- کشف الگوهای ریزمحیط تومور (TME)
- تعیین ریسک و پیشآگهی براساس الگوهای بافتی
در برخی کاربردهای مشخص و در مطالعات پژوهشی کنترلشده مدلهای AI، حساسیتهایی بالاتر از ۹۰–۹۵٪ گزارش شده است.
مدلهای چندوجهی و پیشبینی بیومارکرهای مولکولی
ظهور مدلهای چندوجهی هوش مصنوعی (Multimodal AI) یکی از پیشرفتهترین دستاوردهای پاتولوژی محاسباتی در دهه اخیر بوده است. این مدلها به جای آنکه تنها بر تصاویر Whole Slide تکیه کنند، دادههای مورفولوژیک را با اطلاعات مولکولی مانند پروفایل جهشها، بیان ژنی (RNA-seq) و حتی الگوهای متابولیکی ترکیب میکنند. به طور کلی، مدلهای چندوجهی تصویربرداری WSI را با:
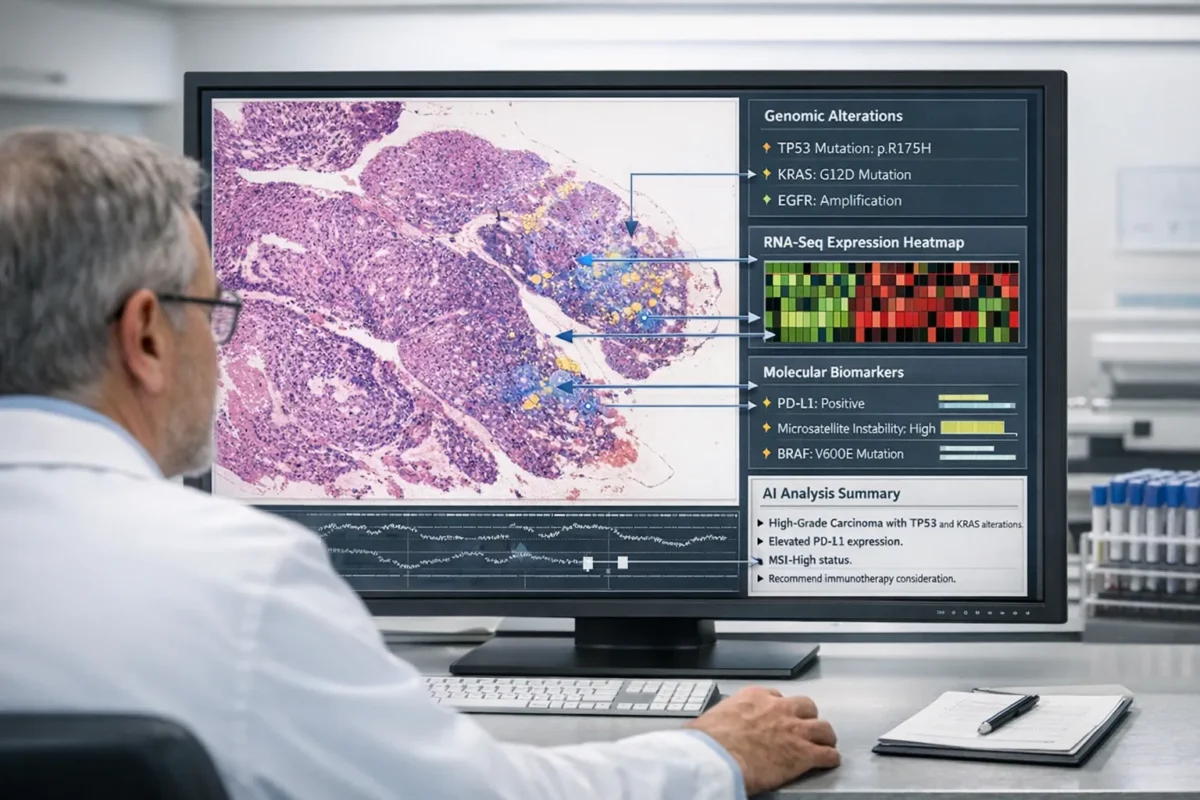
- دادههای ژنومی
- ترنسکریپتومیک
- پروتئومیکس
- دادههای بالینی
- حتی دادههای ایمیجینگ رادیولوژی
ادغام میکنند.
مطالعات نشان میدهند که مدلهای چندوجهی هوش مصنوعی میتوانند موارد زیر را انجام دهند:
- پیشبینی TMB، MSI و امضاهای جهشی
- تعیین بیان ژنی کلیدی مانند PD-L1
- تخمین پاسخ به درمانهای ایمنی
- تحلیل ریزمحیط تومور (Tumor Microenvironment)
- شناسایی الگوهای پنهان که با تومورهای مهاجم مرتبطاند
این مدلها در بسیاری از پروژههای پیشرفته پژوهشی در حال اعتبارسنجی بالینی هستند و انتظار میرود در سالهای آینده وارد دستورالعملهای رسمی شوند.
نقش پاتولوژی مولکولی در پزشکی دقیق و درمانهای هدفمند
پاتولوژی مولکولی امروز بخش جداییناپذیر جریان تشخیص دقیق و پزشکی شخصیسازیشده است و بسیاری از تصمیمهای درمانی بدون اطلاعات مولکولی قابلاتکا نیستند. راهنماهای معتبر مانند WHO تأکید میکنند که تعیین وضعیت جهشهایی مانند EGFR، ALK، KRAS، BRAF، PIK3CA و ویژگیهایی مانند MSI-H و TMB برای انتخاب درمان هدفمند در سرطانهایی نظیر ریه، کولورکتال، ملانوما، پستان و سرویکس ضروری است. مطالعات مختلفی در این زمینه نشان دادهاند که شناسایی این بیومارکرها میتواند احتمال پاسخ به درمانهای هدفمند یا ایمونوتراپی را بهطور معناداری افزایش دهد و از انجام درمانهای غیرضروری جلوگیری کند.
علاوه بر این، تستهای مولکولی نقش مهمی در طبقهبندی دقیق تومورها براساس ویژگیهای ژنومی ایفا کردهاند؛ طبقهبندیهایی که در نسخههای جدید WHO بهشکل رسمی جایگزین بسیاری از طبقهبندیهای صرفاً مورفولوژیک شدهاند. از منظر بالینی، پاتولوژی مولکولی به پزشکان این امکان را میدهد که درمانها را براساس «امضای ژنومی» هر تومور انتخاب کنند و پاسخ به درمان را بهصورت پویا پایش کنند. به همین دلیل است که پزشکی نوین، پاتولوژی مولکولی را نه یک ابزار تکمیلی، بلکه یکی از پایههای تصمیمسازی درمانی میداند.
چالشهای فنی، زیرساختی و مقرراتی در پاتولوژی مولکولی
پاتولوژی مولکولی علیرغم نقش حیاتی خود در تشخیص دقیق و پزشکی شخصی، همچنان با مجموعهای از چالشهای فنی، عملیاتی و مقرراتی مواجه است که میتواند بر کیفیت، صحت و تکرارپذیری نتایج تأثیر بگذارد.
نخستین و شاید مهمترین چالش به کیفیت نمونهها و فرآیندهای پیشتحلیلی مربوط میشود؛ زیرا عواملی مانند روش فیکساسیون، طول زمان قرارگیری بافت در فرمالین، میزان نکروز، یا تخریب DNA/RNA میتوانند باعث کاهش دقت تستهای NGS، MSI و سایر روشهای مولکولی شوند. علاوه بر این، تنوع پلتفرمهای توالییابی و تفاوت بین نرمافزارهای تحلیل داده موجب میشود نتایج بین آزمایشگاهی همیشه سازگار نباشد.
در بخش زیرساخت و تجهیزات نیز چالشهای جدی وجود دارد. پاتولوژی مولکولی نیازمند سیستمهای توالییابی پیشرفته، کیتهای استاندارد، زیرساخت محاسباتی قدرتمند، ذخیرهسازی امن برای دادههای حجیم و نرمافزارهای تخصصی تحلیل است. آزمایشگاههایی که از Whole Slide Imaging و پاتولوژی دیجیتال استفاده میکنند نیز با حجم بسیار بالای دادهها و نیاز به مدیریت تصاویر با رزولوشن بالا مواجهند. بههمین دلیل، بسیاری از مراکز کوچکتر توان ورود به این حوزه را ندارند. در کنار این موارد، الزامات قانونی و اعتباربخشی مانند قوانین CAP، استانداردهای FDA و پروتکلهای کنترل کیفیت، روند ادغام فناوریهای جدید به ویژه ابزارهای مبتنی بر هوش مصنوعی را کندتر و پیچیدهتر کرده است. چالش کمبود نیروی انسانی آموزشدیده در تحلیل دادههای مولکولی و تفسیر یافتهها نیز موضوع دیگری است که بر ظرفیت آزمایشگاهها تأثیر میگذارد.
بهطور کلی، این چالشها نشان میدهند که توسعه و کاربرد گسترده پاتولوژی مولکولی نیازمند ترکیبی از زیرساخت مناسب، استانداردسازی دقیق، سرمایهگذاری هدفمند و تربیت نیروی متخصص است تا آزمایشگاهها بتوانند از ظرفیت واقعی این حوزه در تشخیص دقیق و پزشکی فردمحور بهرهبرداری کامل داشته باشند.
آینده پاتولوژی مولکولی: گذار به تشخیص هوشمند
آینده پاتولوژی مولکولی در مسیری قرار گرفته است که آن را از یک روش صرفاً تشخیصی به یک «سامانه هوشمند تصمیمسازی» تبدیل میکند. این تحول با ترکیب فناوریهای دیجیتال، دادههای مولکولی و توان محاسباتی هوش مصنوعی شکل میگیرد و باعث میشود تشخیص، پیشبینی روند بیماری و انتخاب بهترین درمان، همگی در یک جریان یکپارچه انجام شوند.
یکی از مهمترین روندهای پیشرو، ادغام دادههای مختلف از اطلاعات ژنتیکی و بیان ژنی گرفته تا تصاویر Whole Slide و دادههای بالینی، در قالب مدلهای هوش مصنوعی است. گزارشهای WHO و مطالعات منتشرشده در Nature نشان میدهند که این مدلها میتوانند تغییرات پنهان بافت و بیومارکرهای مهم مانند MSI یا TMB را با دقت بالا پیشبینی کنند، حتی پیش از آنکه در آزمایشهای معمول دیده شوند.

فناوریهای نوینی مانند Spatial Transcriptomics و Multiplex Imaging نیز امکان بررسی دقیق محیط تومور و تحلیل همزمان دهها مولکول را فراهم کردهاند؛ رویکردی که آینده درمانهای هدفمند و ایمنیدرمانی را متحول خواهد کرد. همچنین، آزمایشگاههای هوشمند (Smart Labs) با استفاده از اتوماسیون، روباتیک و سیستمهای دیجیتال مدیریت کیفیت، سرعت و دقت فرآیندهای تشخیصی را بهطور قابل توجهی افزایش میدهند. در نهایت، تحلیلگران در این زمینه پیشبینی میکنند که پاتولوژیستهای آینده نقش پررنگتری در تحلیل دادههای پیچیده و تفسیر مدلهای هوش مصنوعی داشته باشند. به همین دلیل، پاتولوژی مولکولی در سالهای پیشرو نه تنها ابزار تشخیص، بلکه یکی از پایههای اصلی تصمیمگیری درمانی خواهد بود.
در پاسخ به این نیازهای فناورانه و تحولات سریع در پاتولوژی مولکولی و دیجیتال، بهرهگیری از راهکارهای استاندارد و یکپارچه آزمایشگاهی اهمیت دوچندانی پیدا میکند.
راهکارهای پارسژن برای آینده پاتولوژی مولکولی
در مسیری که پاتولوژی مولکولی با سرعتی بیسابقه به سمت دیجیتالسازی، اتوماسیون و تشخیص هوشمند پیش میرود، استفاده از ابزارهای استاندارد، دقیق و قابل اعتماد اهمیت بیشتری پیدا کرده است. شرکت پارسژن با ارائه محصولات مبتنی بر فناوریهای روز با حساسیت بالا، اسکنر اسلایدهای پاتولوژی دیجیتال، راهکارهای پاتولوژی دیجیتال و نرم افزارهای تحلیل داده به آزمایشگاهها کمک میکند تا مسیر گذار به تشخیص مدرن را با اطمینان بیشتری طی کنند. بهرهگیری از این محصولات میتواند کیفیت نتایج، سرعت گزارشدهی و یکپارچگی جریان کاری را بهصورت ملموسی ارتقا دهد و آزمایشگاه را برای ورود به نسل جدید پزشکی دقیق آماده کند. اگر قصد دارید عملکرد بخش پاتولوژی یا واحد مولکولی آزمایشگاه خود را ارتقا دهید، اکنون بهترین زمان برای آشنایی با راهکارهای تخصصی پارسژن و انتخاب محصولاتی است که با نیازهای امروز و آینده شما سازگار هستند.


