in VIVO
In vivo یک اصطلاح لاتین است که بصورت درون زنده یا درون تنی ترجمه میشود. در زمینه مطالعات زیست پزشکی و آزمایشهای علمی، مطالعات in vivo به بررسیها یا آزمایشهای انجام شده در موجودات زنده اطلاق میشود. این موجودات زنده میتواند شامل حیواناتی مانند موش، موش صحرایی یا نخستیها و همچنین انسان در آزمایشهای بالینی باشد.
تحقیقات in vivo یا درون تنی در بردارنده مشاهده و دستکاری فرآیندهای بیولوژیکی درون ارگانیسمهای زنده با در نظر گرفتن فعل و انفعالات پیچیده بین سلولها، بافتها، اندامها و سیستمهای بدن است. با مطالعه موجودات زنده در محیط طبیعی آنها، این امکان برای پژوهشگران ایجاد میشود تا شناخت و دانشی دقیق در مورد نحوه عملکرد سیستمهای بیولوژیکی، پاسخ به محرکها، مکانیسم ایجاد بیماریها و تعامل با درمانهای بالقوه به دست آورند.
مطالعات درون تنی برای درک اثرات فیزیولوژیکی، درمانی و سمی داروها، مواد شیمیایی و مداخلات در زمینه عملکرد کلی بدن ارزشمند هستند. به عبارتی دیگر، مطالعات درون تنی درک جامعتری از چگونگی تأثیر یک روش درمانی یا یک بیماری بر عملکرد کلی ارگانیسم، از جمله عواملی مانند متابولیسم، پاسخ ایمنی، عملکرد اندامها به محققان ارائه میدهند.
ازجمله نمونههایی از آزمایشهای in vivo میتوان به آزمایش اثربخشی یک داروی جدید در مدلهای حیوانی، مطالعه پیشرفت بیماری در موجودات زنده یا بررسی تأثیر عوامل محیطی بر روند سلامت ارگانیسمها اشاره کرد. بطور کلی، تحقیقات in vivo نقش مهمی در پیشرفت دانش ما در مورد شناخت بیولوژی انسانی، مکانیسمهای بیماری و اثرات روشهای درمانی بالقوه ایفا میکند و در نهایت میتواند به توسعه داروها و درمانهای جدید و بهبود شیوههای مراقبتهای پزشکی کمک کند.
فهرست مطالب
مطالعات و تحقیقات In Vivo چیست؟
مطالعات و تحقیقات درون تنی یا in vivo شامل مطالعه فرآیندهای بیولوژیکی در موجودات زنده است، از جمله این موجودات میتوان به ارگانیسمهای مدل ساده مانند مگس میوه تا پستانداران پیچیده مانند موش و انسان اشاره کرد. پژوهشگران میتوانند در مطالعات in vivo نحوه عملکرد سیستمهای بیولوژیکی در محیط طبیعی خود را با در نظر گرفتن تعاملات و برهمکنشهای پیچیده بین سلولها، بافتها، اندامها و کل ارگانیسم انجام دهند. به طور کلی مطالعات درون تنی اطلاعات و شناخت ارزشمندی را در مورد جنبههای فیزیولوژیکی، بیوشیمیایی و فارماکولوژیکی موجودات زنده ارائه میدهد.
ویژگیهای کلیدی مطالعات و تحقیقات درون تنی:
- توانایی مطالعه سیستمهای بیولوژیکی پیچیده در یک موجود زنده: تحقیقات in vivo پیچیدگی سیستمهای بیولوژیکی را نشان میدهد و برای محققان این امکان را ایجاد میکند تا تعاملات پویا بین اجزا و بخشهای مختلف در یک موجود زنده را مورد مطالعه قرار دهند.
- فرصتی برای بررسی اثرات داروها یا درمانها در کل ارگانیسم، از جمله تعامل با اندامها و سیستمهای مختلف: یافتههای حاصل از مطالعات in vivo بیشتر از نظر فیزیولوژیکی اهمیت دارند، زیرا پاسخ موجودات زنده به محرکها، درمانها یا بیماریهای مختلف را منعکس میکنند.
- توانایی تقلید شرایط بیماری انسان: در مطالعات درون تنی با ایجاد شرایطی مشابه با بیماری انسان در مدلهای حیوانی میتوان به درک و شناخت بیشتر از روند بیماری دست یافت.
- بررسی عملکرد داروها در بدن ارگانیسمها: در مطالعات درون تنی این امکان ایجاد میشود که ویژگیهای فارماکوکینتیک و فارماکودینامیک داروها در یک موجود زنده مورد بررسی قرار گیرد.
در روند انجام مطالعات درون تنی باید این نکته را نیز مدنظر قرار داد که انجام این تحقیقات مستلزم رعایت دستورالعملهای اخلاقی برای اطمینان از رفتار انسانی با حیوانات درگیر در مطالعات است.
تصویربرداری فلورسنت
تصویربرداری فلورسنت به عنوان یک تکنیک تصویربرداری غیرتهاجمی شناخته میشود که میتواند به مشاهده و مطالعه فرآیندهای بیولوژیکی در حال وقوع در یک موجود زنده کمک کند. در این تکنیک از پروبها یا کاوشگرهای فلورسنت استفاده میشود. این کاوشگرها مولکولهایی هستند که وقتی در معرض طول موج خاصی از نور قرار میگیرند، از خود نور ساطع میکنند. تصویربرداری فلورسنت به محققان این امکان را میدهد تا حرکت و فعالیت مولکولها یا سلولهای خاص را در بدن ردیابی کرده و مورد بررسی قرار دهند. تصویربرداری فلورسنت به طور گسترده در مطالعه فرآیندهای سلولی، مانند بیان ژن، محلی سازی پروتئین و مسیرهای سیگنالینگ سلولی مورد استفاده قرار میگیرد.
این تکنیک حساسیت بالا، قابلیتهای چندگانه (تشخیص چندین هدف بطور همزمان) و سازگاری با طیف وسیعی از پروبهای فلورسنت را ارائه میدهد.
نفوذ محدود به بافت به دلیل پراکندگی نور، اتوفلورسنت پس زمینه و فتوبلیچینگ فلوروفورها از جمله محدودیتهای این روش به شمار میآيد.
از این تکنیک در مطالعه فرآیندهای سلولی، بیان ژن، محلی سازی پروتئین و مسیرهای سیگنال دهی سلولی در داخل بدن استفاده میشود.
تصویربرداری بیولومینسانس
دراین تکنیک از تصویربرداری، از آنزیمهای ساطع کننده نور مانند لوسیفراز (Luciferase) برای مشاهده فرآیندهای بیولوژیکی در موجودات زنده استفاده میشود. با استفاده از سلولها یا ارگانیسمهای بیان کننده لوسیفراز، پژوهشگران میتوانند رشد تومورها را ردیابی کرده، بیان ژن را کنترل کنند و پاسخهای ایمنی را به صورت Real time مورد مطالعه و بررسی قرار دهند. تصویربرداری بیولومینسانس بویژه برای مطالعات طولی و ارزیابی پاسخهای درمانی میتواند بسیار موثر واقع شود.
این روش حساسیت بالایی دارد و با حداقل سیگنال پس زمینه میتواند ردیابی طولانی مدت سلولها یا ارگانیسمها را فراهم کند.
تصویربرداری بیولومینسانس نیاز به سلولها یا ارگانیسمهای بیان کننده لوسیفراز دارد که همین امر کاربردهای آن را به مدلهای اصلاح شده ژنتیکی محدود میکند.
از این تکنیک میتوان در نظارت بر رشد تومور، بیان ژن، پاسخهای ایمنی و اثربخشی دارو در داخل بدن استفاده کرد.
توموگرافی انتشار پوزیترون (PET)
پت اسکن شامل استفاده از ردیابهای رادیویی (radioactive tracers) یا هستهای (ماده رادیواکتیو) است که پوزیترونهایی را منتشر میکنند و این انتشار توسط اسکنر PET قابل تشخیص است. این تکنیک امکان مشاهده فرآیندهای متابولیک، اتصال گیرنده و توزیع دارو در بدن را فراهم میکند. تصویربرداری PET اغلب در انکولوژی یا تحقیقات سرطان، بیماریهای مغز و اعصاب و نارساییهای قلبی برای تشخیص بیماریها و نظارت بر پاسخهای درمانی مورد استفاده قرار میگیرد.
این تکنیک حساسیت بالایی را برای تشخیص فرآیندهای متابولیک، اتصال گیرنده و توزیع دارو در داخل بدن ارائه میدهد.
از جمله محدودیتهای تصویربرداری PET میتوان به وضوح فضایی محدود، قرار گرفتن در معرض تابش به دلیل استفاده از ردیابهای رادیویی و هزینه نسبتا بالا اشاره کرد.
از تصویربرداری PET در مطالعات انکولوژی، نورولوژی، قلب و عروق و همچنین مطالعات توسعه دارو استفاده میشود.
تصویربرداری تشدید مغناطیسی (MRI)
به عنوان تصویربرداری رزونانس مغناطیسی نیز شناخته میشود، یک تکنیک تصویربرداری پزشکی غیرتهاجمی محسوب میشود که از میدانهای مغناطیسی و امواج رادیویی برای تولید تصاویر دقیق از ساختارهای داخلی بدن با جزئیات استفاده میکند. در این تکنیک از یک میدان مغناطیسی قوی و امواج رادیویی برای تولید تصاویری از اندامها، بافتها و سایر ساختارها استفاده میشود. MRI درون تنی میتواند تصاویری با وضوح بالا از بافتها، اندامها و رگهای خونی ارائه دهد که به این ترتیب امکان مشاهده و بررسی تغییرات آناتومیکی و عملکردی را در پاسخ به بیماری یا درمان فراهم میکند. MRI بطور گسترده در روشهای بالینی برای تشخیص انواع مشکلات پزشکی مورد استفاده قرار میگیرد.
وضوح فضایی بالا، ایجاد کنتراست عالی در بافت نرم و قابلیتهای تصویربرداری چند پارامتری از جمله نقاط قوت این تکنیک به شمار میآيد.
این تکنیک حساسیت کمتری در مقایسه با PET برای تصویربرداری مولکولی دارد و همچنین زمان انجام آن طولانیتر و هزینه بیشتری ایجاد میکند.
تصویربرداری تشریحی و عملکردی از بافتها، اندامها، رگهای خونی و ساختارهای مغز در داخل بدن از کاربردهای MRI محسوب میشود.
توموگرافی کامپیوتری (CT)
اشعه ایکس و پردازش کامپیوتری را برای ایجاد تصاویر مقطعی از بدن ترکیب میکند. تصویربرداری CT درون تنی قادر است اطلاعات دقیقی در مورد ساختار و تراکم بافتها ارائه دهد و همچنین دادههایی ارزشمندی را برای تشخیص شرایطی مانند شکستگی استخوان، تومور و ناهنجاریهای عروقی ایجاد کند. تصویربرداری CT اغلب در شناسایی سرطانها و بررسی شکستگیها مورد استفاده قرار میگیرد.
وضوح فضایی بالا، زمان دست یابی سریع و ایجاد تصویر با کیفیت بالا از ساختارهای استخوانی و بافتهای نرم را ارائه میدهد.
از جمله محدودیتهای این روش میتوان به کنتراست محدود بافت نرم در مقایسه با MRI، قرار گرفتن در معرض تابش یونیزان و خطرات بالقوه مرتبط با ماده حاجب یا کنتراستزا (Radiocontrast agent) اشاره کرد.
از تصویربرداری CT میتوان برای مشکلات ایجاد شده در اثر حوادث، انکولوژی و تصویربرداری از شکستگیهای استخوان، تومورها و ناهنجاریهای عروقی استفاده کرد.
توموگرافی انسجام نوری (OCT)
یک تکنیک تصویربرداری به شمار میآید که از امواج نور برای ایجاد تصاویر با وضوح بالا و مقطعی از بافتها استفاده میکند. تصویربرداری درون تنی OCT معمولاً در چشم پزشکی برای مشاهده شبکیه و عصب بینایی و همچنین در مطالعات قلب و عروق برای ارزیابی عروق خونی و عملکرد قلب میتواند به کار گرفته شود. OCT تکنیکی غیرتهاجمی است که تصاویری به صورت Real time و با وضوح میکرون ارائه میکند.
تصویربرداری با وضوح بالا و مقطعی از بافتها با جزئیات در سطح میکرون، قابلیتهای تصویربرداری به صورت Real time و تصویربرداری غیرتهاجمی از شبکیه و عصب بینایی را ارائه میدهد.
عمق نفوذ محدود در بافتها، حساسیت به حرکت بیمار حین تصویربرداری و میدان دید محدود از جمله محدودیتهای این روش به شمار میآید.
از این تکنیک در چشم پزشکی برای تصویربرداری شبکیه، در تحقیقات قلب و عروق برای تصویربرداری از عروق و بیماریهای پوست به منظور تصویربرداری از سلولهای پوستی استفاده میشود
در یک محیط مصنوعی خارج از بدن، مانند لوله آزمایش یا پتری دیش در آزمایشگاه.
آشنایی با تصویربرداری مولکولی in vivo
در تحقیقات پیش بالینی، تصویربرداری مولکولی in vivo یک حوزه مهم محسوب میشود که از ترکیب زیست شناسی مولکولی و تکنیکهای تصویربرداری پیشرفته برای تصویربرداری از تغییرات بیوشیمیایی و فیزیولوژیکی در سطح مولکولی در ارگانیسمهای زنده استفاده میکند. برای تصویربرداری از مولکولهای زیستی، دانش زیست شناسی مولکولی، زیست شناسی سلولی، بیوشیمی و فیزیولوژی باید در کنار یکدیگر قرار گیرند.
تکنیکهای تصویربرداری مانند فلورسنت (Fluorescence Imaging)، لومینسانس (Luminescence imaging)، توموگرافی کامپیوتری با گسیل تک فوتون یا اسپکت (SPECT)، توموگرافی گسیل پوزیترون یا پت اسکن (PET)، توموگرافی کامپیوتری یا سی تی اسکن (CT) و تصویربرداری رزونانس مغناطیسی (MRI) برای تصویربرداری مولکولهای زیستی بکار گرفته میشود.
این تکنیکهای تصویربرداری در زمینههای مختلفی مانند تشخیص بیماریها، توسعه داروهای جدید و ارزیابی اثرات آنها مورد استفاده قرار میگیرند. به دلیل اینکه تصویربرداری بیومولکولی میتواند بطور پیوسته تصاویر را بدون آسیب به بافتهای زیستی یا از بین بردن یکپارچگی بافتها به دست آورد، تغییرات در طول زمان بخوبی قابل ارزیابی هستند.
فنوتیپها یا بیماریها در ارگانیسم زنده به دلیل تجمع پدیدههای مختلف زیستی در بدن به وجود میآیند. تفاوتهای ژنتیکی باعث ایجاد تغییرات بیوشیمیایی و فیزیولوژیکی میشود و در نهایت تغییرات آناتومیکی یا ساختاری را ایجاد میکند. به منظور بررسی این تغییرات میتوان از تکنیکهای تصویربرداری بیومولکولی استفاده کرد.
در ارزیابی تغییرات آناتومیکی یا ساختاری، به کارگیری تکنیکهای MRI، CT اسکن و سونوگرافی مزایایی در تولید تصاویر از جمله وضوح بالا ایجاد میکند. همچنین، استفاده از تکنیکهای SPECT و MRI برای ارزیابی پدیدههای فیزیولوژیکی بسیار موثر است. برای تصویربرداری از پدیدههای بیوشیمیایی در داخل بدن، میتوان از تکنیکهای PET و MRI استفاده کرد. با اینحال، استفاده از تکنیکهای تصویربرداری مناسب برای هر هدف از اهمیت ویژهای برخوردار است.
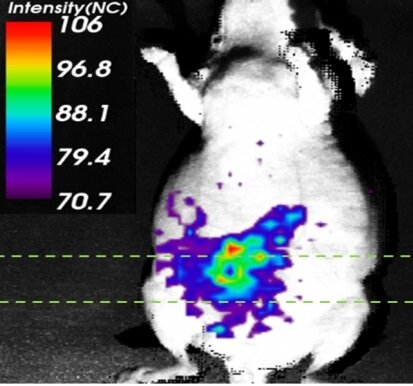
تصویر برداری مولکولی درون تنی چیست؟
تصویربرداری مولکولی in vivo یک رویکرد پیشرفته در تصویربرداری به شمار میآيد که تغییرات بیوشیمیایی و فیزیولوژیکی را که در سطح مولکولی در ارگانیسمهای زنده رخ میدهد، به تصویر میکشد. فلورسنت، لومینسانس، تکنیک اسپکت (SPECT)، توموگرافی گسیل پوزیترون (PET)، سی تی اسکن (CT) و تصویربرداری MRI از جمله تکنیکهایی هستند که برای ایجاد تصاویر مولکولی درون بدن یا in vivo مورد استفاده قرار میگیرند. هر یک از این روشهای تصویربرداری مزایا و محدودیتهای خود را دارند که میتوانند برای اهداف خاصی مورد استفاده قرار بگیرند.
هر بیماری یا فنوتیپ در یک موجود زنده به دلیل وجود رویدادهای مختلف بیولوژیکی ایجاد میشود. برخی از تغییرات ژنتیکی در بدن میتواند باعث تغییرات بیوشیمیایی یا فیزیولوژیکی شود که در نهایت به تغییرات ساختاری یا تشریحی منجر میشود. به همین دلیل، محققان باید روشهای تصویربرداری بیومولکولی مناسب را برای موضوعات تحقیقاتی خود به کار ببرند.

شکل 1. انواع فنآوری تصویربرداری مولکولی برای پدیدههای بیولوژیکی
تغییرات ژنتیکی اولین گام به سوی بروز یک بیماری یا تغییر در یک موجود زنده محسوب میشود. این تغییرات بیوشیمیایی و فیزیولوژیکی در هر ارگانیسم به دلیل تجمع تغییرات و جهشهای ژنتیکی ایجاد میشود. این تغییرات فیزیولوژیکی و بیوشیمیایی تغییرات آناتومیکی در ارگانیسمها را به وجود میآورد. برای مطالعه و تشخیص بیماریها، استفاده از تکنیکهای تصویربرداری مناسب امری ضروری به شمار میآید.
استفاده از تکنیکهای تصویربرداری CT اسکن و MRI میتواند به ایجاد تصاویری با وضوح بالا منجر شود و بنابراین برای ارزیابی ساختارهای آناتومیکی، این تکنیکها گزینه مناسبی به حساب میآیند. اما تکنیکهای CT اسکن و MRI حساسیت کمتری برای ارزیابی فرآیندهای بیوشیمیایی با وضوح بالا دارند. حساسیت در اینجا به معنای توانایی تشخیص فرآیندهای بیولوژیکی است و بطور کلی از این اصطلاح در رادیولوژی استفاده میشود.
تکنیکهای تصویربرداری زیستی نوری (Optical bioimaging techniques)، مانند فلورسنت و بیولومینسانس، حساسیت بالایی برای ارزیابی فرآیندهای بیولوژیکی دارند اما محدودیتهایی مانند کمیت و نفوذ به عمق بافت نیز در این تکنیکها وجود دارد. بطور کلی، تصویربرداری نوری قادر به ارزیابی فعالیت سلولی در بافت عمیق بدن ارگانیسم زنده نیست.
رادیوداروها یا داروهای رادیواکتیو (Radiopharmaceuticals) در تصویربرداری پزشکی هستهای به منظور ارزیابی فرآیندهای متابولیک یا فیزیولوژیکی که در بدن ارگانیسمهای زنده اتفاق میافتد، استفاده میشوند. روشهای ترکیبی تصویربرداری پزشکی هستهای مانند اسکنهای SPECT/CT و PET/CT را میتوان در مطالعات پیش بالینی مورد استفاده قرار داد. بطور کلی، تکنیکهای SPECT/CT یا PET/CT وضوح تشریحی کمتر و حساسیت عملکردی بالاتری نسبت به CT و MRI ارائه میدهند.
این روشها نسبت به تصویربرداری نوری از حساسیت کمتری برخوردارند، اما کمیت بالایی دارند و همچنین، هیچ محدودیتی در بافتهای عمیق ندارند. استفاده از پروب یا رادیودارو به تصویربرداری نوری یا تصویربرداری پزشکی هستهای ابعاد جدیدی اضافه میکند. در این مطلب، تکنیکهای مختلف تصویربرداری مولکولی in vivo را برای شناخت و بررسی مزایا و معایب آنها معرفی خواهیم کرد. با آشنایی با این تکنیکها، پژوهشگران میتوانند برای انجام سریعتر مطالعات خود تکنیکهای مناسب تصویربرداری مولکولی in vivo را انتخاب کنند.
| تکنیکهای تصویربرداری | وضوح | اطلاعات عمق | زمان تصویربرداری | حساسیت |
|---|---|---|---|---|
| CT | ۵۰ μm | بدون محدودیت | در حد دقیقه | مشخص نشده است |
| MRI | 10–100 μm | بدون محدودیت | در حد دقیقه و ساعت | 3-10~ 5- 10mol/L |
| Bioluminescence | 1mm - 2mm | 1cm - 2cm > | در حد دقیقه | -1015 ~ -1017 mol/L |
| Fluorescence | 1mm - 2mm | 1cm > | در حد ثانیه و دقیقه | 10-9 ~10-12 mol/L |
| SPECT | 0.5mm - 2mm | بدون محدودیت | در حد دقیقه | 10-10 ~10-11 mol/L |
| PET | 0.1mm - 1mm | بدون محدودیت | در حد دقیقه | 10-11 ~ 10-12 mol/L |
ویژگیهای روشهای تصویربرداری مولوکولی
تکنیکهای تصویربرداری زیستی نوری
میکروسکوپ، بویژه زمانیکه برای مقاصد in vitro (خارج از ارگانیسم زنده) یا ex vivo (در یک محیط مصنوعی) استفاده میشود، به عنوان گستردترین فناوری تصویربرداری نوری در زمینه تصویربرداری بیولوژیکی مورد استفاده قرار میگیرد. تمرکز اصلی میکروسکوپ در کاوش پدیدههای سلولی نهفته است. از طریق این روش نوری، ما میتوانیم دادههای بیولوژیکی ارزشمندی را در یک موجود زنده به صورت Real time بدست آوریم و اطلاعات مهمی را در مورد فرآیندهای بیولوژیکی مختلف ارائه کنیم.
توسعه پروبهای بیولومینسانس، پروبهای فلورسانس، انواع پروبهای فلورسانس عملکردی و نانوذرات فلورسنت که فرآیندهای بیولوژیکی خاص را هدف قرار میدهند، باعث پیشرفت سریع تصویربرداری مولکولی نوری میشود. تصویربرداری نوری، در مقایسه با سایر تکنیکهای تصویربرداری بیومولکولی، مزیت زمان ثبت تصاویر نسبتاً سریع و حساسیت بالا را ارائه میدهد.
جنبه فنی کلیدی تصویربرداری زیستی نوری در تشخیص دقیق نور ساطع شده از موجودات زنده نهفته است. دستگاههای بار جفت شده یا (CCD) برای تشخیص سیگنالهای نور کم با حساسیت بسیار بالا در دسترس قرار دارند. آشکارسازهای CCD از یک سطح تراشه سیلیکونی تشکیل شدهاند که به پیکسلهای حساس به نور متعدد تقسیم شده است. این دستگاهها فوتونهای دریافتی را با طول موجهای 300 تا 1000 نانومتر و انرژیهای 2 تا 3 eV به سیگنالهای الکتریکی برای ثبت تصویر تبدیل میکنند.
با اینحال، این فرآیند در شبکه سیلیکونی گرما ایجاد میکند که منجر به بروز نویز گرمایی میشود که میتواند حساسیت دستگاه را کاهش دهد. در گذشته، در تجهیزات تصویربرداری نوری از دستگاههای CCD ثابت متصل به واحدهای خنک کننده برای حفظ دمای پایین در اتاقهای تاریک استفاده میکردند. امروزه، پیشرفتها منجر به ایجاد سیستمهای دوربین یکپارچه با مکانیزمهای خنک کننده داخلی شده است. چالش در مدیریت تولید گرمای دستگاههای CCD برای جلوگیری از گرمای بیش از حد است که میتواند بر کیفیت تصویر تأثیر بگذارد. با وجود این که دستگاههای CCD مدرن پیشرفتهایی را تجربه کردهاند، اما همچنان محدودیتهای قابل توجهی را نشان میدهند.
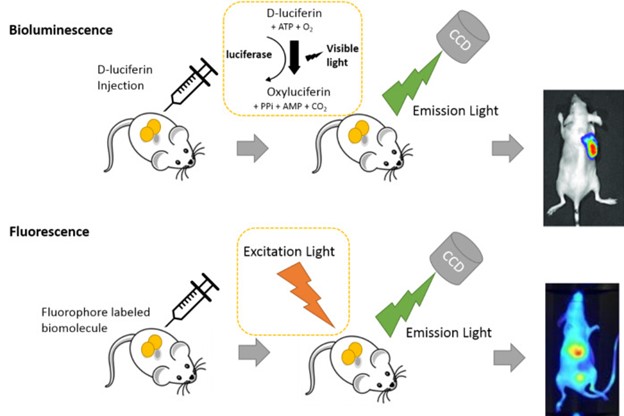
شکل 2. اصول اولیه فلورسانس و بیولومینسانس
در تصویربرداری نوری بیولومینسانس، نور تولید شده توسط لوسیفراز در یک موجود زنده قبل از خروج از بدن، جذب و در داخل بافت پراکنده میشود. هموگلوبین که عمدتا در گلبولهای قرمز خون یافت میشود، جز اصلی جذب کننده نور در بدن است، به ویژه در طیفهای آبی و سبز در طول موجهای زیر 600 نانومتر جذب اتفاق میافتد. در مقابل، نور لوسیفراز آزمایشگاهی در طیف قرمز بین 600 تا 1000 نانومتر قرار میگیرد. لوسیفراز کرم شب تاب Photinus pyralis (Fluc)، نور را در طیف گستردهای از طول موجها، از جمله 560 نانومتر و بالاتر از 600 نانومتر ساطع میکند که آن را برای تصویربرداری بیولومینسانس مناسب میکند.
Fluc با D-luciferin، یک سوبسترا اختصاصی، برهمکنش میکند، آنرا اکسید کرده و به oxyluciferin تبدیل میکند و در این فرآیند نور ساطع میکند. این واکنش به اکسیژن، منیزیم و آدنوزین تری فسفات (ATP) نیاز دارد.
تصویربرداری بیولومینسانس مزایای منحصر به فردی را در واکنشهای آنزیم-سوبسترا ارائه میدهد. اولاً، فعالسازی لوسیفراز نیازی به تابش نور خارجی ندارد. برای تولید نور فقط D-luciferin، ATP، اکسیژن و منیزیم لازم است. ثانیاً، حضور D-luciferin سرعت گردش آنزیم را افزایش میدهد، از تجمع آنزیم در سلولها جلوگیری میکند و امکان گرفتن تصاویر مکرر را هر چند ساعت یکبار فراهم میکند. علاوه بر این، شدت نور تولید شده با غلظت آنزیم ارتباط مثبت دارد.
در حالیکه این ویژگیها سودمند هستند، محققان باید عوامل خاصی را هنگام استفاده از تصویربرداری بیولومینسانس در آزمایشها در نظر بگیرند. درک فرآیند بیولوژیکی مورد مطالعه و انتخاب یک ژن گزارشگر مناسب بسیار اهمیت دارد. گرفتن تصاویر در فواصل زمانی مختلف پس از تزریق D-luciferin برای تعیین نقطه زمانی تصویربرداری بهینه برای مقایسه تصاویر از یک سوژه در طول ساعت یا برای گرفتن یک تصویر ضروری است. سینتیک رسیدن D-luciferin به سلولهای هدف، امری حیاتی در نظر گرفته میشود، زیرا تصویربرداری بدون در نظر گرفتن این نکته ممکن است منجر به نتایج غیربهینه شود.
در تصویربرداری بیولومینسانس، معمولا از لوسیفراز و لوسیفرین کرم شب تاب استفاده میشود. در نتیجه، استفاده از ارگانیسمها یا سلولهای اصلاح شده ژنتیکی برای بیان لوسیفراز در فرآیند بیولوژیکی مورد مطالعه ضروری است. ارزیابی تصاویر تحت تأثیر تزریق داخل صفاقی لوسیفرین برای هدف قرار دادن منطقه خاص مورد نظر، قرار میگیرد.
در مقابل، تصویربرداری بیوفلورسانس شامل استفاده از یک ماده یا پروتئین فلورسنت است. نور ساطع شده از مواد فلورسنت، تحریک شده توسط نور خارجی، برای گرفتن تصویر استفاده میشود. هنگام برنامه ریزی آزمایش، محققان باید اتوفلورسانس را در نظر بگیرند که میتواند با نور خارجی، با توجه به بافت مورد مطالعه، القا شود. این عامل برای اطمینان از ارزیابی و تفسیر دقیق تصویر بسیار مهم است.
تصویربرداری فلورسنت in vivo
یک دوربین CCD در تصویربرداری فلورسنت استفاده میشود، جاییکه پروتئینهای فلورسنت و نانوذرات در معرض نور با طول موج خاصی قرار میگیرند که آنها را تحریک میکند. به دنبال این مراحل، پروتئینهای فلورسنت و نانوذرات برانگیخته، نوری با طول موج خاصی ساطع میکنند که سپس توسط دوربین CCD گرفته و تصویربرداری میشود. تصویربرداری نوری بیوفلورسنت را میتوان به روشهای مختلفی انجام داد. یک روش شامل گرفتن تصاویری از حیوانات یا سلولهایی است که ژن پروتئین فلورسنت را بیان میکنند. روش دیگر شامل تزریق یک کاوشگر حاوی پروتئین فلورسنت، ماده فلورسنت یا نانوذرات برای گرفتن تصویر است.
انتخاب روش انجام تصویربرداری باید براساس اهداف آزمایش انجام شود. به عنوان مثال، پروتئین فلورسانس سبز (GFP) هنگامیکه توسط نور در 395 نانومتر تحریک میشود، نور سبز را در طول موج 509 نانومتر ساطع میکند. با این حال، GFP ممکن است محدودیتهایی در هنگام تصویربرداری به دلیل همپوشانی سیگنالها با اتوفلورسانس پوست موش ایجاد کند. برای برطرف کردن این مشکل، پروتئینها یا فلوروفورهایی که فلورسانس با طول موج بلندتر تولید میکنند، توسعه یافته و مورد استفاده قرار گرفتهاند.
هنگام تصویربرداری از بافتها یا سلولهای عمیق، انتقال نور تحریک باید در طراحی مطالعات تصویربرداری نوری بیوفلورسنت در نظر گرفته شود. بطوری که هنگام استفاده از تصویربرداری نوری بیوفلورسنت روی موش، وجود مو روی بدن حیوان باید در نظر گرفته شود. تصویربرداری از حیواناتی که پوشش موی زیادی دارند، میتواند چالش برانگیز باشد و یکی از روشها حذف مو از ناحیه خاص مورد بررسی است.
از طرف دیگر، اطمینان از عدم تداخل رنگ مو با نور تحریک یا نور ساطع شده اهمیت دارد. علاوه بر این، هنگام هدف قرار دادن مناطق عمیق مورد نظر، عبور نور باید در نظر گرفته شود. به عنوان مثال، سیگنال پروتئین GFP ممکن است با اتوفلورسانس پوست همپوشانی داشته باشد. برای کاهش همپوشانی سیگنال، استفاده از فلوروفورهای گسیلی با طول موج بلند توصیه میشود. هنگام ارزیابی فرآیندهای بیولوژیکی در بافتهای عمیق، توانایی نفوذ نور برانگیختگی و انتشار از اهمیت بالایی برخوردار است. در چنین مواردی، فلوروفورهای نزدیک به مادون قرمز باید به دلیل افزایش قابلیت نفوذ در بافت در نظر گرفته شوند.
تصویربرداری زیست مولکولی با استفاده از توموگرافی کامپیوتری با انتشار تک فوتون
تصویربرداری مسطح و توموگرافی دو دسته اصلی از تکنیکهای تصویربرداری به شمار میآیند که در این تکنیکها از پرتوهای گاما استفاده میشود. براساس نحوه تشخیص اشعه گاما، توموگرافی را میتوان به توموگرافی تک فوتونی و PET طبقه بندی کرد. اشعه گاما با استفاده از توموگرافی تک فوتونی بیشتر از PET مورد شناسایی قرار میگیرد.
برای رفع محدودیتهای وضوح تصاویر مسطح، میتوان از کولیماتورهای پینهول با تصاویر گاما استفاده کرد. با این حال، نقطه ضعف استفاده از کولیماتور پینهول، طولانی شدن زمان تصویربرداری است که مانع از تولید تصاویر با وضوح بالا میشود. علاوه بر این، هنگامی که از یک کولیماتور پینهول استفاده میشود، حساسیت کاهش مییابد و وضوح فضایی با افزایش فاصله بهبود پیدا میکند، در نتیجه کارایی سیستم گرفتن تصویر کم میشود.
با افزایش اندازه سوراخ کولیماتورهای پینهول حساسیت تصویربرداری بهبود مییابد، اما از وضوح فضایی کاسته میشود. تصویربرداری از حیوانات کوچک به تعادلی از وضوح فضایی کم و حساسیت بالا نیاز دارد.
برای غلبه بر این چالشها، یک اسکنر SPECT/CT برای حیوانات کوچک براساس یک کولیماتور چند سوراخه ساخته شده است. این نوآوری، وضوح SPECT را به کمتر از 1 میلیمتر افزایش میدهد و با استفاده از یک کولیماتور چند سوراخه حساسیت را افزایش میدهد. این پیشرفت امکان ایجاد یک میدان دید موثر گسترده را فراهم میکند و محدودیتهای مرتبط با کولیماتورهای سنتی پین هول را برطرف میکند و قابلیتهای تصویربرداری را برای تحقیقات حیوانات کوچک بهبود میبخشد.
تصویربرداری زیست مولکولی با استفاده از توموگرافی گسیل پوزیترون یا پت اسکن
PET (توموگرافی انتشار پوزیترون) شامل یک رادیودارو است که به یک ایزوتوپ رادیواکتیو ساطع کننده پوزیترون متصل شده و سپس به بدن تزریق میشود. یک دستگاه PET برای ردیابی توزیع، زیست شناسی و بیوشیمی رادیوداروهای تزریقی مورد استفاده قرار میگیرد. این روش امکان تصویربرداری و تجزیه و تحلیل کمی از ویژگیهای بیوشیمیایی یا عملکردی در بدن را فراهم میکند.
هنگامی که پوزیترون گسیل شده با الکترونهای اطراف برخورد میکند، الکترونها نابود میشوند و در نتیجه دو پرتو گامای keV 511 به صورت 180 درجه در جهت مخالف از یکدیگر حرکت میکنند. یک تصویر PET با بازسازی یک تصویر از پرتوهای گامای شناسایی شده با استفاده از یک آشکارساز دایرهای در یک اسکنر PET ایجاد میشود.
اهمیت تصویر PET از نظر بیوشیمی یا فیزیولوژی به رادیوداروی خاص مورد استفاده بستگی دارد. سیکلوترونهای پزشکی برای تولید رادیوداروها به منظور تصویربرداری PET ضروری به شمار میآیند. این سیکلوترونها برای تولید رادیو ایزوتوپهای ساطع کننده پوزیترون مورد نیاز هستند و تجهیزات اضافی مانند هات سل و دستگاههای سنتز برای سنتز رادیوداروهای مختلف با استفاده از رادیو ایزوتوپهای تولید شده مورد نیاز است.
| رادیوایزوتوپ | انرژی (keV) | نیمه عمر | رادیوداروها |
|---|---|---|---|
| 99 mTc | 144 | 6 ساعت | 99mTc-MDP (متاستازهای استخوانی) 99mTc-MIBI (پرفیوژن میوکارد) 99mTc-HMPAO (پرفیوژن مغز) 99mTc-ECD (پرفیوژن مغز) 99mTc-DMSA (قشر کلیه) 99mTc-DTPA (عملکرد کلیه) 99 mTc-MAG3 (عملکرد کلیه) 99mTc-HSA (مایع لنفاوی) |
| 125I | 35 | 59.6 روز | I125 (تیروئید) I125 -آنتی بادی پروتئین-125I |
| 123I | 159 | 13.2 ساعت | (تیروئید) 123I -MIBG (عملکرد کلیه) 123 I -IudR (تکثیر سلولی) 123I |
خلاصه ردیابهای تصویربرداری SPECT
تصویربرداری با استفاده از پراکندگی رامان ارتقا یافته سطحی (SERS)
پراکندگی رامان (Raman scattering) که به عنوان اثر رامان نیز شناخته میشود، پدیدهای است که در آن طول موج نور با پراکندگی تغییر میکند. این اثر اولین بار در سال 1928 توسط C.V. رامان و کریشن کشف شد. در پراکندگی رامان، بخشی از نور پراکنده، انرژی اولیه خود را حفظ میکند، اما ممکن است مقداری از نور در مقایسه با نور فرودی، انرژی دریافت کند یا از دست بدهد. این برخلاف پراکندگی رایلی (Rayleigh scattering) است که در آن نور با حفظ انرژی اولیه خود پراکنده میشود.
همانطور که در بالا اشاره شد، در طیف سنجی رامان، زمانی که نور با یک نمونه برهمکنش میکند، بخشی از نور پراکنده شده به دلیل برهمکنش با مولکولهای نمونه، دچار تغییر انرژی میشود. نوار استوکس (Stokes band) یک خط طیفی مشخصه است که در مقایسه با نور فرودی در طیف رامان با انرژی کمتر (طول موج بلندتر) ظاهر میشود.
موقعیت نوار استوکس و تعداد مولکولهای موجود را میتوان برای تعیین انرژی حالت ارتعاش در پراکندگی رامان مورد استفاده قرار داد. به دلیل انرژی نسبتا کم پراکندگی رامان، نانوذرات اغلب برای تقویت سیگنال رامان برای تصویربرداری درون تنی به کار میروند. طیفسنجی رامان تقویت شده سطحی از نانوذرات پلاسمونیک برای تولید طیفهای بسیار شدید و متمایز شبیه اثرانگشت استفاده میکند.
نانوذرات SERS یک پلت فرم همه کاره با قابلیتهای مختلف ارائه میدهد. این قابلیتها شامل چندوجهی بودن و حساسیت استثنایی به دلیل طیف سنجی رامان تقویت شده سطحی و اثرات تشدید مولکولی است. آنها همچنین هدف گیری مولکولی فعال را از طریق عملکرد سطحی با مولکولهای هدف امکان پذیر میکنند.
علاوه بر این، نانوذرات SERS امکان تصویربرداری چندگانه را فراهم میکنند، بطوری که طیف مولکولهای مختلف گزارشگر رامان به شناسایی نشانگرهای خاص کمک میکند. از سویی دیگر، این نانوذرات میتوانند در کاربردهای چندوجهی مورد استفاده قرار گیرند، در این حالت هسته فلزی، معمولاً طلا، میتواند بهعنوان عامل کنتراست برای اسکنهای CT، MRI، PET و SPECT به طور همزمان عمل کند.
با استفاده از نانوذرات چندوجهی، میل ترکیبی آنتیبادیهایی که یک اپی توپ را هدف قرار میدهند در داخل بدن ارزیابی میشود. این رویکرد امکان ارزیابی میل آنتیبادی را در یک محیط سازگار در داخل بدن فراهم میکند و اطلاعاتی را ارائه میدهد که ممکن است با ارزیابیهای آزمایشگاهی متفاوت باشد. آنتیبادیهای متفاوتی که اپیتوپ یکسانی را هدف قرار میدهند، میتوانند براساس سیگنال SERS منتشر شده توسط نانوذراتی که با آنها برچسبگذاری شدهاند، متمایز شوند که همین امر امکان ارزیابی دقیق میل ترکیبی آنها را فراهم میکند.
کاربرد سیستمهای تصویربرداری in vivo در زمینه پزشکی و تحقیقات بیولوژیکی
در سالهای اخیر، حوزه تصویربرداری پزشکی پیشرفتهای قابل توجهی را شاهد بوده است که همین امر نحوه مطالعات و شناخت و درک چگونگی فرآیندهای بیولوژیکی موجودات زنده را متحول کرده است. یکی از هیجانانگیزترین پیشرفتها در زمینه تصویربرداری پزشکی، ظهور سیستمهای تصویربرداری in vivo یا درون تنی است. این فناوریهای پیشرفته، برای محققان و پزشکان این امکان را ایجاد میکند تا رویدادهای سلولی و مولکولی را به صورت Real timeدر موجودات زنده مشاهده و ردیابی کنند و به این ترتیب میتوانند به شناخت ارزشمندی در مورد پیشرفت بیماری، اثربخشی درمان و توسعه دارو دست یابند.
در سیستمهای تصویربرداری In vivo از طیف وسیعی از روشهای تصویربرداری، از جمله فلورسنت، بیولومینسانس و توموگرافی انتشار پوزیترون (PET) برای ثبت تصاویر با وضوح بالا از فرآیندهای بیولوژیکی به صورت Real time استفاده میشود. با معرفی عوامل کنتراست یا پروبهای فلورسنت که مولکولها یا بافتهای خاصی را هدف قرار میدهند، محققان قادر خواهند بود تا حرکت، فعالیت و تعاملات این اهداف را در بدن مورد بررسی قرار دهند.
خلاصه مطلب
سنجشهای آزمایشگاهی معمولاً برای ارزیابی فرآیندهای بیولوژیکی درون سلولها یا بافتها در یک نقطه زمانی خاص استفاده میشوند. در نتیجه، ارزیابی این فرآیندها در طول زمان با استفاده از چندین حیوان مدل آزمایشگاهی قابل انجام است. در این حالت است که با استفاده از تصویربرداری مولکولی in vivo، محققان میتوانند رویدادهای بیولوژیکی متوالی را بررسی کنند.
در حالیکه طیف وسیعی از تکنیکهای تصویربرداری زیست مولکولی را میتوان برای ارزیابی پدیده های بیولوژیکی متنوع به کار برد، هر روش دارای مجموعهای از نقاط قوت و محدودیتهای خاص خود است. از این رو، انتخاب تکنیکهای تصویربرداری که با اهداف تحقیقاتی خاص در دست همسو باشد، از اهمیت بالایی برخوردار است.