تلومر
تلومر (Telomere) ساختارهای متمایزی از DNA هستند که در انتهای کروموزوم یافت میشوند. تلومرها توالیهای کوتاه از DNA هستند که بارها و بارها تکرار شده اند. توالی تلومر در انسان TTAGGG است. این دنباله معمولاً حدود 3000 بار تکرار میشود و طول آن به 15000 جفت باز میرسد.
در گلبولهای سفید، طول تلومر با افزایش سن کاهش مییابد، بطوری که طول تلومرها، حدود 8000 جفت باز در نوزادان، حدود 3000 جفت در بزرگسالان و تا 1500 جفت در افراد مسن تخمین زده میشود. هنگامیکه یک سلول تقسیم میشود، 30 تا 200 جفت باز از تلومرهای خود را از دست میدهد. در نتیجه، قبل از اینکه تلومرها به اندازه کافی کوتاه شوند تا سلولها غیرفعال شوند یا بمیرند، سلولها معمولاً میتوانند تنها 50 تا 70 بار تقسیم شوند. با اینحال، در بافتهایی که سلولها بطور مکرر تقسیم نمیشوند، مانند ماهیچه قلب، طول تلومرها کاهش نمییابد.

تاریخچه شناسایی تلومرها
در دهه 1930، هرمان مولر (Hermann Muller) با تحقیقاتی درباره کروموزومها و جهشزایی، به ویژگیهای خاص انتهای کروموزومها پی برد و اصطلاح “تلومر” (از واژههای یونانی telo به معنی «پایان» و mere به معنای «قسمت») را برای توصیف این نواحی معرفی کرد.
او همچنین با استفاده از اشعه ایکس بر روی مگس سرکه، تأثیرات جهشزایی را بررسی کرد و متوجه شد که این انتهای کروموزومی بطور غیرمنتظره ای در برابر جهشها مقاوم هستند. این مشاهده، مولر را به این فرضیه رساند که تلومرها عملکرد ویژه ای دارند و میتوانند انتهای کروموزومها را مهر و موم کنند.
امروزه میدانیم که تلومرها در حفظ ثبات و یکپارچگی انتهای کروموزومها نقش حیاتی دارند، اما خودشان حاوی ژنهای فعالی نیستند. آنها شامل توالیهای تکراری DNA هستند و به همراه پروتئینهای خاص، ساختاری منحصر به فرد را در انتهای کروموزومها ایجاد میکنند که از آسیب به اطلاعات ژنتیکی موجود در کروموزوم جلوگیری میکند. تلومرها بعنوان یک سپر محافظ در برابر فرایندهای تخریب ژنتیکی عمل میکنند و نقش مهمی در پیری و بیماریهای مرتبط با آن دارند.
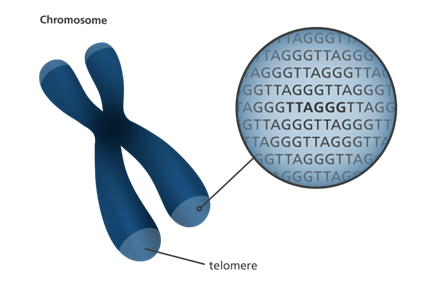
محل قرارگیری تلومرها در انتهای کروموزومها
تاریخچه تلومرها را باید در روند پیشرفت علوم ژنتیک و زیست شناسی سلولی مورد بررسی قرار داد. در اینجا تحولات کلیدی در مسیر شناخت ما از تلومرها آمده است:
- کشف (دهه 1970): تلومرها اولین بار در اوایل دهه 1970 توسط محققانی که ساختار کروموزومها را مطالعه میکردند، بویژه در ارگانیسم مدل Saccharomyces cerevisiae (مخمر نان) شناسایی شدند. در این مسیر، دانشمندانی مانند الیزابت بلکبرن، کارول گریدر و جک شوستاک نقشی اساسی در این کشف ایفا کردند و نشان دادند که تلومرها توالیهای DNA تکراری هستند که در انتهای کروموزومها قرار دارند؛
- عملکرد تلومر (دهه 1980): در این دوره دانشمندان فعالیت خود را در زمینه کشف عملکرد تلومرها در محافظت از انتهای کروموزوم در برابر تخریب و جلوگیری از همجوشی آنها آغاز کردند. براساس این مطالعات مشخص شد که تلومرها نقش مهمی در حفظ ثبات ژنومی دارند. نتایج مطالعات نشان داد که تلومرها با هر تقسیم سلولی کوتاه میشوند، پدیده ای که با پیری سلولی مرتبط است؛
- کشف تلومراز (1985): آنزیم تلومراز که طول تلومر را حفظ کرده و آن را طویل میکند، توسط الیزابت بلکبرن و کارول گریدر کشف شد. این کشف اطلاعات ارزشمندی را در مورد اینکه چگونه سلولهای خاصی مانند سلولهای بنیادی و سلولهای سرطانی میتوانند با حفظ طول تلومر خود بطور نامحدود تکثیر شوند، ارائه کرد؛
- ارتباط تلومر با پیری و سرطان (دهه 1990): تحقیقات در این دهه ارتباط واضحی را بین کوتاه شدن تلومر و پیری سلولی (فرآیندی که در آن سلولها توانایی خود را برای تقسیم از دست میدهند) ایجاد کرد. همچنین مشخص شد که بسیاری از سلولهای سرطانی تلومراز را دوباره فعال میکنند و به آنها اجازه میدهد فرآیندهای پیری سلولی طبیعی را دور بزنند. این منجر به درک بهتر نقش تلومرها در پیری و توسعه سرطان شد؛
- جایزه نوبل (2009): کار بلکبرن، گریدر، و شوستاک در مورد کشف تلومراز و بررسی عملکرد تلومرها در ثبات کروموزومها با جایزه نوبل فیزیولوژی یا پزشکی در سال 2009 شناخته شد. از زمان دریافت جایزه نوبل در سال 2009، تحقیقات در مورد تلومرها و تلومراز سرعت گرفته است. دانشمندان در حال بررسی نقش طول تلومر و حفظ آن در شرایط مختلف، از جمله بیماریهای قلبی عروقی، بیماری آلزایمر و سایر اختلالات مرتبط با افزایش سن هستند. همچنین تحقیقات پیوسته ای برای توسعه روشهای درمانی در حال انجام است که میتوانند فعالیت تلومراز را دستکاری کنند، برای مبارزه با سرطان با مهار تلومراز وارد عمل شوند یا در بیمارهای مرتبط با افزایش سن برای افزایش ظرفیت بازسازی از تلومرازها استفاده کنند؛
- تحقیقات در حال انجام (2010-اکنون): تحقیقات در مورد تلومرها همچنان ادامه دارد. دانشمندان پیامدهای زیست شناسی تلومر را در زمینه های مختلف از جمله پیری، پزشکی احیا کننده و درمانهای سرطان بررسی کرده اند. مطالعات نشان داده اند که طول تلومر میتواند تحت تاثیر عوامل محیطی، انتخاب سبک زندگی و استرس قرار تغییر کند؛
بدون تلومرها، انتهای کروموزومها میتوانند با هم ترکیب شوند و طرح ژنتیکی سلول را تغییر داده و احتمالاً باعث اختلال در عملکرد سلول، سرطان یا مرگ سلولی شوند. از آنجاییکه DNA شکسته خطرناک است، یک سلول توانایی تشخیص و ترمیم آسیب کروموزوم را دارد.
بدون تلومرها، انتهای کروموزومها مانند DNA شکسته در نظر گرفته میشود و به همین دلیل سلول تلاش میکند چیزی را که شکسته نشده است، تعمیر کند. وجود این مشکل همچنین موجب میشود که سلولها دست از تقسیم سلولی بردارند و در نهایت بمیرند.
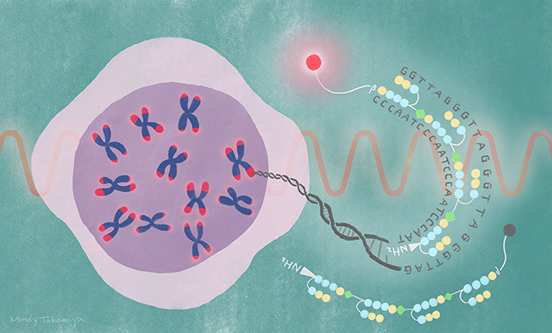
توالی تلومرهای انسان
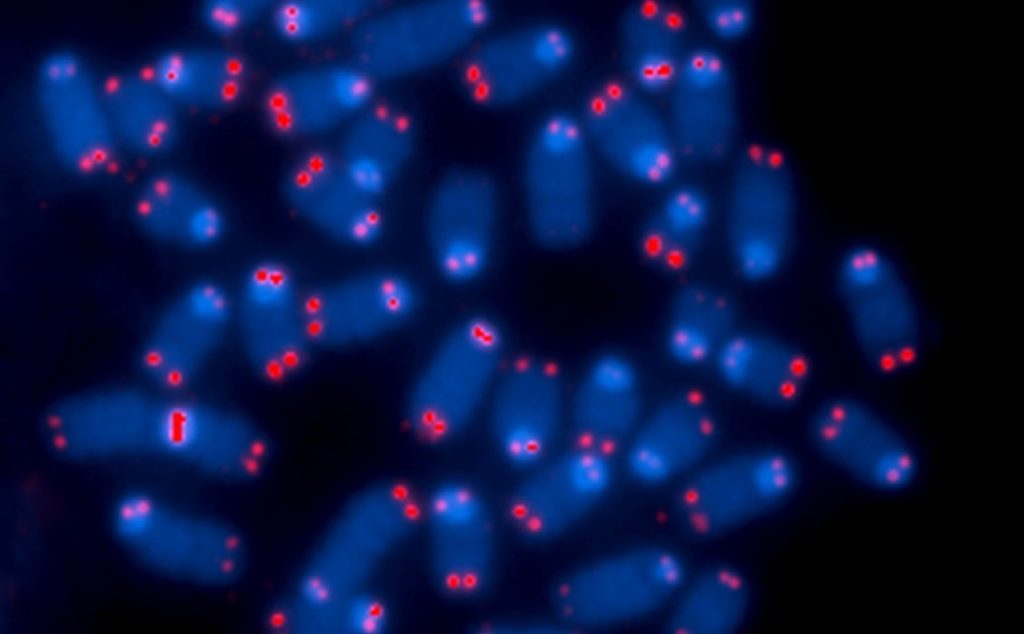
ساختمان کروموزومها با توالی انتهایی تلومر که با رنگ قرمز مشخص شده است
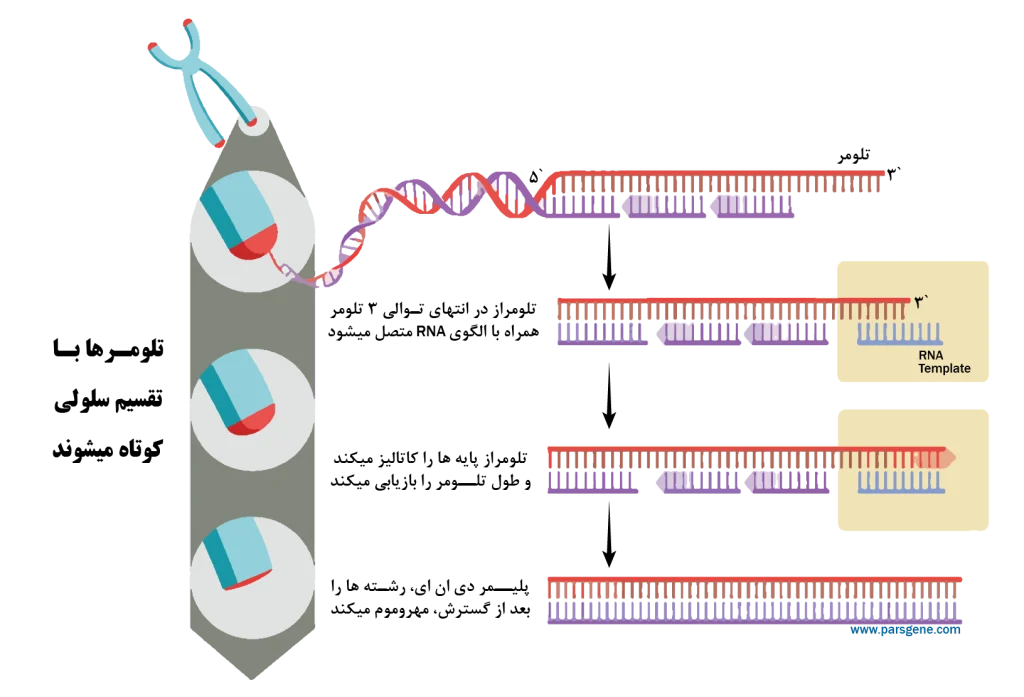
تلومرها در انتهای کروموزومها قرار دارند، جاییکه به محافظت در برابر از دست دادن DNA در طول همانندسازی کمک میکنند
هدف تلومرها
محافظت از کروموزومها
تلومرها بعنوان کلاهکهای محافظ برای انتهای کروموزوم عمل کرده و از شناسایی آنها بعنوان DNA آسیب دیده جلوگیری میکنند. در نتیجه از یکپارچگی اطلاعات ژنتیکی در طول تقسیم سلولی محافظت میکنند.
پیشگیری از دست دادن اطلاعات ژنتیکی
تنظیم تقسیم سلولی
طول تلومر یک عامل کلیدی در پیری سلولی و طول عمر محسوب میشود. با تقسیم سلولی، تلومرها کوتاه میشوند که در نهایت باعث پیری سلولی (وضعیت توقف تقسیم سلولی) یا آپوپتوز (مرگ برنامه ریزی شده سلولی) پس از رسیدن به طول بسیار کوتاه میشود. این مکانیسم میتواند از تقسیم سلولی کنترل نشده که با سرطان مرتبط است، جلوگیری کند.
نقش تلومرها در پیری
تلومرها نقش بسزایی در روند پیری دارند. کوتاه شدن تدریجی تلومرها در طول زمان با کاهش بازسازی بافت بدلیل افزایش سن در ارتباط است. همین امر نشاندهنده ارتباط بین طول تلومرها و پیری سلولها و ارگانیسمها است.
تلومرها چگونه با کوتاه شدن مقابله میکنند؟
تلومراز آنزیمی است که توالی تلومر TTAGGG را به انتهای کروموزومها اضافه میکند. این آنزیم تنها در غلظتهای بسیار کم در سلولهای سوماتیک بدن یافت میشود. از این رو، بدلیل فعالیت کم تلومراز در این سلولها پیری اتفاق میافتد و سلولها به مرور زمان عملکرد طبیعی خود را از دست میدهند.
در سلولهای بنیادی و سلولهای زایا مثل تخمک و اسپرم، تلومراز در سطوح بالایی وجود دارد. در این سلولها طول تلومر پس از تکثیر DNA حفظ میشود و به همین دلیل این سلولها دچار پیری نمیشوند. اگر سلولهای تولید مثلی، تلومراز برای حفظ طول تلومرهای خود نداشتند، تمام موجودات زنده با چنین سلولهایی به زودی منقرض میشدند.
علاوه بر این، در سلولهای سرطانی نیز غلظتهای بالایی از آنزیم تلومراز مشاهده میشود. از این رو، سلولهای سرطانی نامیرا میشوند و میتوانند بصورت مداوم به تکثیر خود ادامه دهند. اگر تلومراز در سلولهای سرطانی غیرفعال شود، تلومرهای آنها تا رسیدن به «طول بحرانی» کوتاه میشوند. بنابراین غیرفعال شدن تلومرازها، از تقسیم غیرقابل کنترل سلولهای سرطانی برای تشکیل تومور جلوگیری میکند.
همانطور که مشخص است، تنها طول تلومر نیست که مهم است، بلکه شکل و ساختار تلومر نیز اهمیت دارد. تلومرهای سالم حلقه های کوچکی به شکل گیره کاغذ در انتهای کروموزومها ایجاد میکنند، از این رو، انتهای کروموزومها جمع شده و مورد حفاظت قرار میگیرد. هر چه تلومرها کوتاهتر شوند ایجاد این حلقه انتهایی دشوارتر خواهد شد. زمانیکه تلومر به حدی کوتاه شود که حلقه در انتهای کروموزم از بین رود، انتهای کروموزوم آشکار میشود که زنگ خطر را برای نشان دادن وجود DNA شکسته در سلول به صدا در میآورد. در این زمان تقسیم سلولی متوقف میشود و سلول وارد روند پیری شده و آسیبهای سلولی قابل ترمیم نیستند و همچنین عملکرد سلول به آهستگی انجام میشود، تا جاییکه سلول از بین میرود.
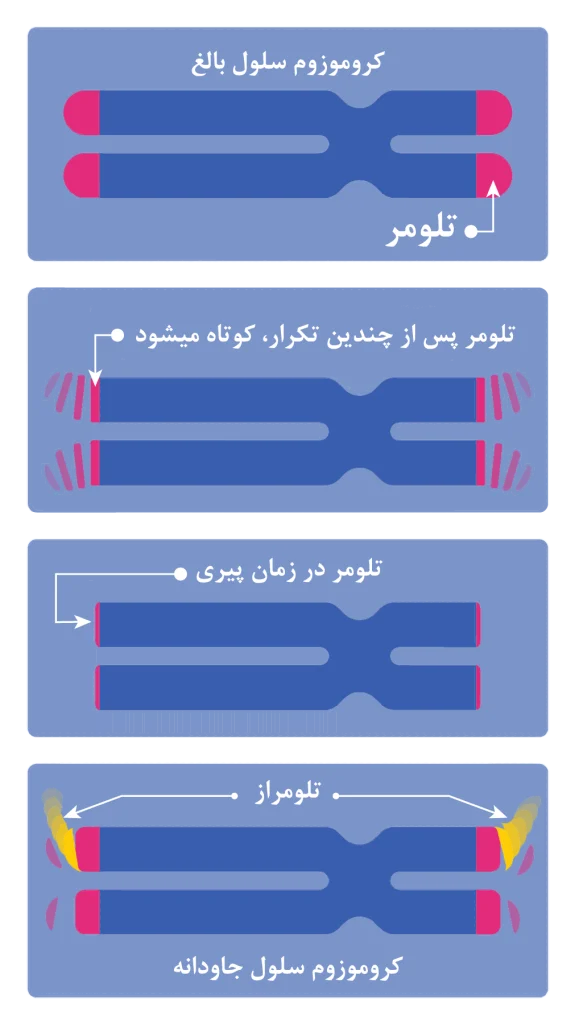
در بیشتر سلولهای بدن، تلومرها بتدریج قبل از پیری سلول کوتاه میشوند. با اینحال، در سلولهای تخمک و اسپرم، آنزیمی به نام تلومراز به بازسازی تلومرها ادامه میدهد و از پیری سلولها جلوگیری میکند
طول تلومرها تحت تاثیر چه عواملی قرار میگیرد؟
طول تلومرهای کروموزوم تحت تأثیر چندین عامل مختلف قرار دارد، در ادامه به برخی از این عوامل اشاره میشود:
- سن: بطور کلی، با افزایش سن بدن، طول تلومرها کاهش مییابد. کوتاه شدن تلومرها بدلیل تعداد دفعات تقسیم سلولی است که منجربه از دست دادن بخشهایی از تلومرها در هر تقسیم میشود؛
- استرس اکسیداتیو: قرارگیری در معرض استرس اکسیداتیو مانند رادیکالهای آزاد میتواند در ایجاد آسیب در DNA و کوتاهی تلومرها موثر باشد؛
- تنشهای مکانیکی: براساس مطالعات کروموزومی، مشخص شده است که تنشهای مکانیکی میتوانند تأثیراتی بر طول تلومرها و همچنین بر عملکرد آنها داشته باشند؛
- سبک زندگی: فاکتورهای سبک زندگی مانند رژیم غذایی، تمرین بدنی، خواب و مدیریت استرس ممکن است بر طول تلومرها تأثیرگذار باشد. بطور کلی، زندگی سالم میتواند به حفظ طول تلومرها کمک کند.
- نژاد و ژنتیک: برخی صفات و ویژگیهای ژنتیکی و نژادی نیز میتوانند بر طول تلومرها تأثیر بگذارند. افراد مختلف ممکن است به دلیل تفاوتهای ژنتیکی دارای تلومرهای بلندتر یا کوتاهتر باشند؛
- بیماریها: برخی بیماریها و مشکلات پزشکی، مانند دیابت، چاقی و بیماریهای قلبی، با کوتاهی تلومرها ارتباط دارند؛
این عوامل مجموعاً بر طول تلومرها و نهایتاً بر سلامتی و سن حیات سلولها تأثیر میگذارند.
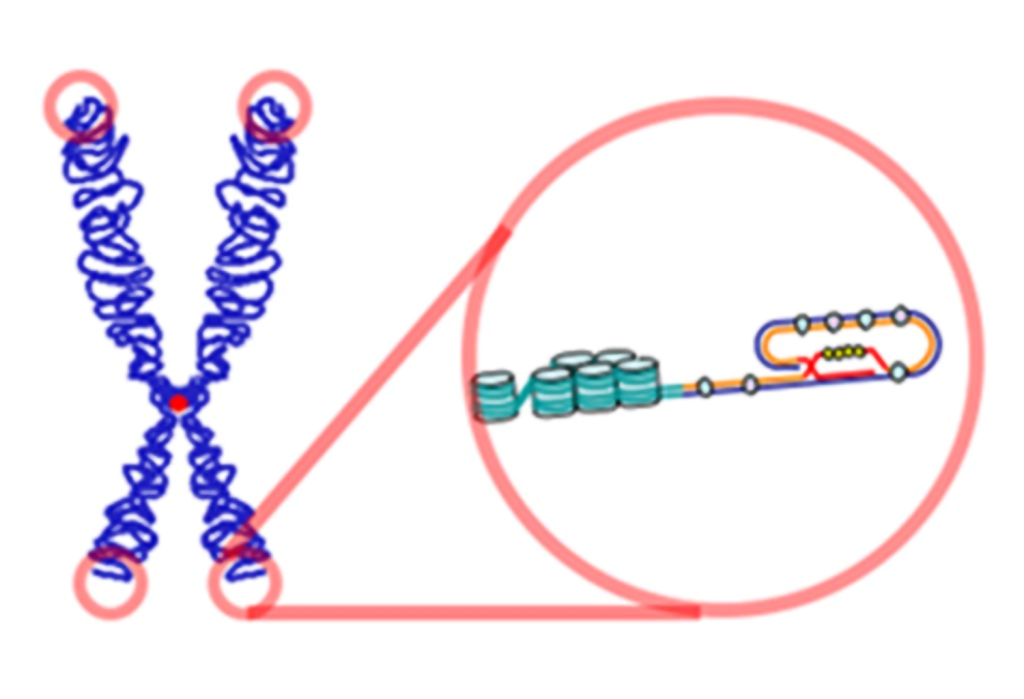
ایجاد ساختارهای حلقه ای در تلومرها با کمک برخی پروتئینها انجام میشود
تلومرها و سرطان
سلولهای انسان بطور طبیعی به شکل کنترل شدهای تقسیم میشوند و هر بار که تکثیر اتفاق میافتد، تلومرهای آنها کمی کوتاهتر میشوند. زمانیکه سلولها به سمت سرطانی شدن پیش میروند، کنترل بر تقسیم سلولی از بین میرود و سلول بطور غیرقابل کنترلی تقسیم میشود.
در این وضعیت، تلومرها به سرعت کوتاه میشوند. اگر تلومرها به حدی کوتاه شوند که به سلول آسیب بزنند، معمولاً سلول میمیرد. با اینحال، برخی از سلولهای سرطانی دارای غلظتهای بالایی از آنزیمهای تلومراز فعال هستند که میتوانند تلومرها را بازسازی کنند و به سلول این امکان را میدهد که به تقسیم و رشد خود ادامه دهد و از کوتاهی تلومرها و مرگ سلولی فرار کند.
تحقیقات نشان میدهد که در بسیاری از انواع سرطانها، از جمله سرطانهای پانکراس، استخوان، پروستات، مثانه، ریه، کلیه و سر و گردن، تلومرها بصورت غیرطبیعی کوتاه شدهاند. بنابراین، اندازهگیری سطوح تلومراز ممکن است به عنوان یک روش برای تشخیص سرطان مورد استفاده قرار گیرد.
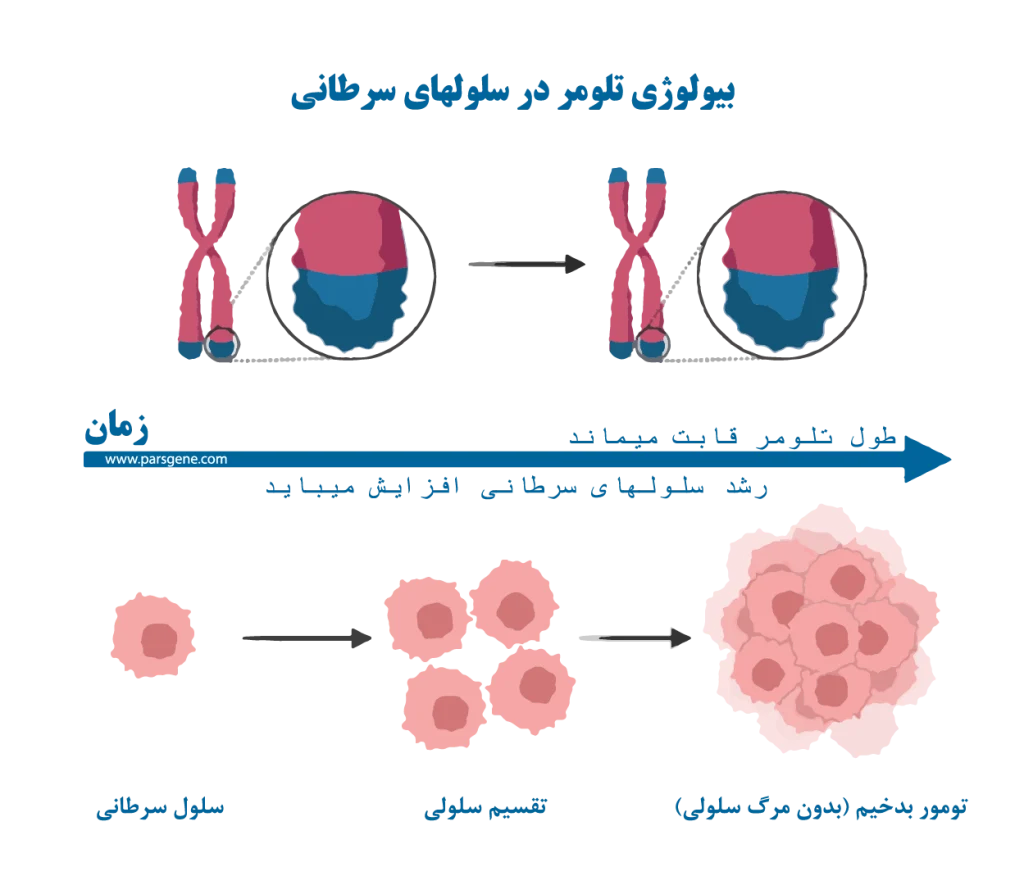
تلومرها در سلولهای سرطانی
تلومرها و پیری
تلومرها که ساختارهای محافظتی در انتهای کروموزومها هستند، با هر بار تقسیم سلولی کوتاه میشوند. این پروسه یکی از دلایل اصلی محدودیت تقسیم سلولی است. بطور خاص، به ازای هر بار تقسیم سلولی، بین 25 تا 200 باز از تلومرها از بین میرود. دو عامل اصلی در کوتاه شدن تلومرها عبارتند از:
- مشکل تکثیر پایانی: این مشکل به از دست رفتن DNA در انتهای کد ژنتیکی اشاره دارد و معمولاً منجربه از دست دادن حدود 20 جفت باز در هر تقسیم میشود؛
- استرس اکسیداتیو: این عامل شامل آسیب ناشی از رادیکالهای آزاد است که میتواند منجربه از دست رفتن حتی 50 تا 100 جفت باز در هر تقسیم شود. عوامل سبک زندگی مانند تغذیه نامناسب، سیگار کشیدن و استرس بر شدت استرس اکسیداتیو تأثیر میگذارند؛
زمانیکه تلومر خیلی کوتاه میشود، کروموزوم به «طول بحرانی» میرسد و دیگر قابل تکثیر نیست. این طول بحرانی با فرآیندی به نام آپوپتوز که به عنوان مرگ برنامهریزیشده سلولی نیز شناخته میشود، به مرگ سلول میانجامد.
ریچارد کاتون (Cawthon)، متخصص ژنتیک و همکارانش در دانشگاه یوتا دریافتند که تلومرهای کوتاهتر با عمر کوتاهتر مرتبط هستند. در میان افراد بالای 60 سال، افرادی که تلومرهای کوتاهتری داشتند، سه برابر بیشتر در معرض خطر مرگ ناشی از بیماری قلبی و هشت برابر بیشتر در معرض خطر مرگ ناشی از بیماریهای عفونی بودند.
در حالیکه کوتاه شدن تلومر با روند پیری مرتبط است، هنوز مشخص نیست که تلومرهای کوتاهتر فقط نشانه پیری هستند (مانند موهای خاکستری) یا در واقع به پیری کمک میکنند.
مطالعه کاتون نشان داد که وقتی افراد براساس طول تلومر به دو گروه تقسیم میشوند، افرادی که تلومرهای بلندتری دارند بطور متوسط پنج سال بیشتر از آنهایی که تلومرهای کوتاهتری دارند، عمر میکنند. در نتیجۀ این مطالعه مشخص شد که با افزایش طول تلومرها در افراد با تلومر کوتاهتر، میتوان طول عمر را پنج سال افزایش داد.
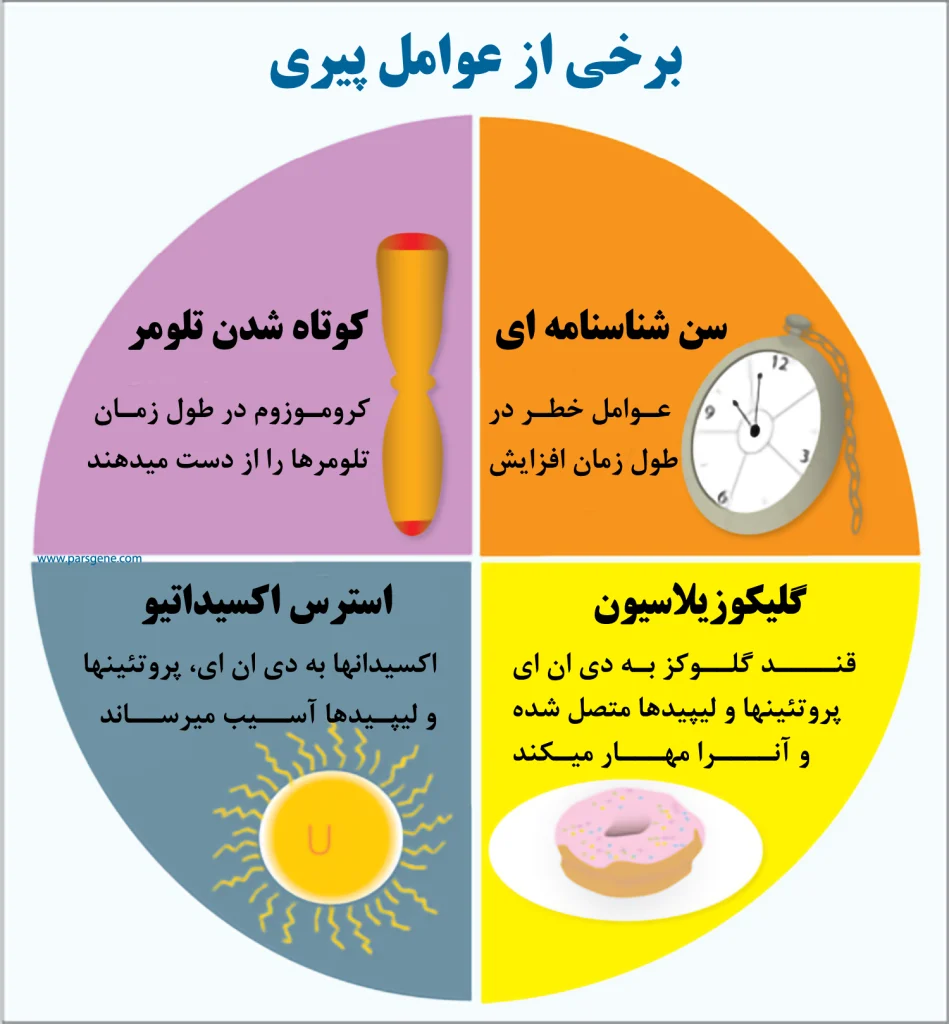
عوامل موثر بر روند پیری
بطور طبیعی، افرادی که تلومرهای بلندتری دارند همچنان با افزایش سن، کوتاه شدن تلومر را تجربه میکنند. کاتون معتقد است با متوقف کردن کامل کوتاه شدن تلومر ممکن است 10 سال و شاید 30 سال بطول عمر انسان اضافه شود.
پس از 60 سالگی، خطر مرگ هر 8 سال دو برابر میشود. دادهها نشان میدهند که تنها 4٪ از تفاوت در میزان مرگ و میر بطول تلومر مرتبط است و عواملی چون سن، جنسیت و ترکیب آنها، 37٪ از تغییرات در خطر مرگ را توضیح میدهند.
یکی از دلایل اصلی پیری استرس اکسیداتیو در نظر گرفته میشود. استرس اکسیدایتو به معنای آسیب به DNA، پروتئینها و لیپیدها توسط اکسیدانها است که مواد بسیار واکنش پذیر حاوی اکسیژن هستند. این اکسیدانها بطور طبیعی هنگام تنفس تولید میشوند و همچنین در نتیجه التهاب، عفونت و مصرف الکل و سیگار در بدن بوجود میآید.
در یک مطالعه، دانشمندان با قرار دادن کرمها در معرض دو ماده ای که اکسیدانها را خنثی میکنند، طول عمر کرمها را بطور متوسط 44 درصد افزایش دادند.
یکی دیگر از عوامل پیری گلیکوزاسیون است. گلیکوزاسیون زمانی اتفاق میافتد که گلوکز، قند اصلی که بعنوان انرژی در بدن مصرف میشود. به برخی از DNA، پروتئینها و لیپیدهای بدن متصل شده و این مولکولها دیگر قادر به انجام وظایف خود نیستند.
گلیکوزاسیون با افزایش سن تشدید میشود و باعث اختلال در عملکرد بافتهای بدن و در نتیجه منجر به بیماری و مرگ میشود. گلیکوزاسیون ممکن است توضیح دهد که چرا مطالعات روی حیوانات آزمایشگاهی مشخص کرده است که محدود کردن کالری دریافتی باعث افزایش طول عمر میشود.
به احتمال زیاد استرس اکسیداتیو، گلیکوزاسیون، کوتاه شدن تلومر و سن تقویمی همراه با ژنهای مختلف همه با هم باعث پیری میشوند.
تلومرها و سایر بیماریها
افراد مبتلا به بیماری dyskeratosis congenita (نقص کراتین سازی مادرزادی) تلومرهایی دارند که خیلی سریعتر از حد معمول کوتاه میشوند. افراد مبتلا به این بیماری دچار پیری و مرگ زودرس میشوند. مبتلایان به این نقص با خطر بالاتر عفونتهای تهدید کننده زندگی، لوکمیا و سایر سرطانهای خون، اختلالات روده، سیروز کبدی و فیبروز ریوی، سفت شدن کشنده بافت ریه مواجه هستند. همچنین، این افراد بیشتر احتمال دارد موهای خاکستری، طاسی، بهبود ضعیف زخم، لکههای روی پوست، اختلالات روده، نرم شدن استخوانها و ناتوانیهای یادگیری را تجربه کنند.
مطالعات در زمینه ی این بیماری مشخص کرده است که تلومرها ممکن است در همه این شرایط نقش داشته باشند، زیرا همه آنها بافتهایی را درگیر میکنند که سلولها اغلب در آنها تقسیم میشوند. در مطالعاتی که در زمینه ی بیماری آلزایمر، سخت شدن شریانها، فشار خون بالا و دیابت نوع 2 انجام شده است، شواهدی از ارتباط کوتاهی تلومرها با این بیماریها به دست آمده است.
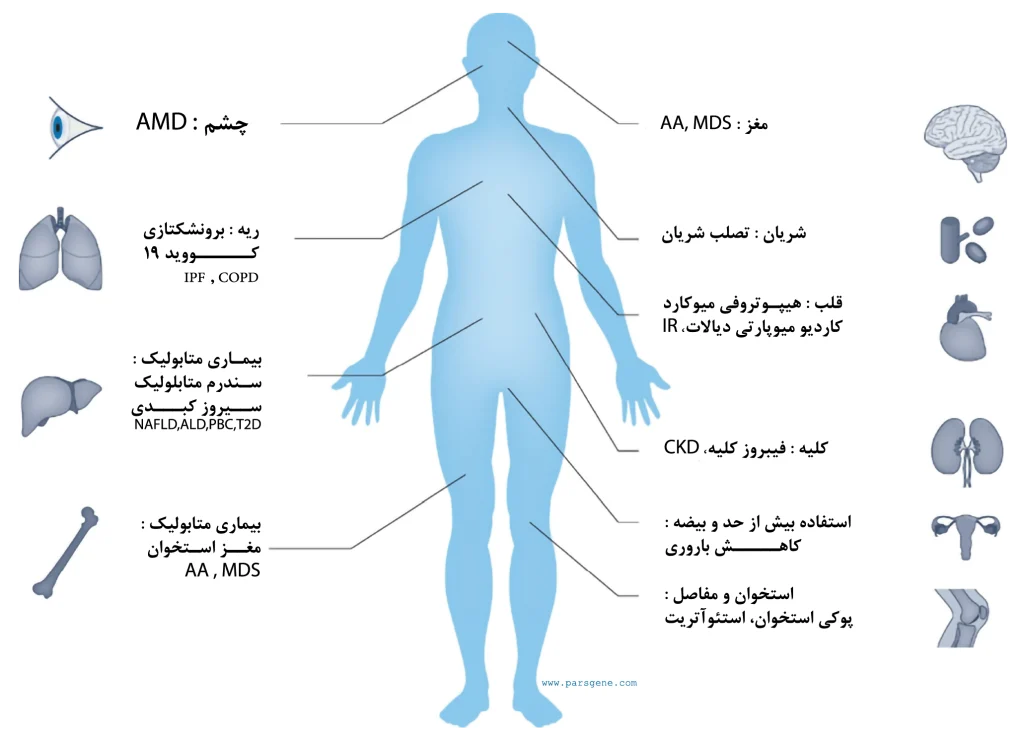
در تصویر بالا برخی از بیماریهای مربوط به سن و تلومرها توضیح داده شدهاند، براساس اندامها یا سیستمها گروهبندی شدهاند. AA آمیلوئیدوز، کم خونی آپلاستیک؛ AD، بیماری آلزایمر؛ ALD، بیماری کبد الکلی؛ AMD، دژنراسیون ماکولای وابسته به سن؛ CKD، بیماری مزمن کلیوی؛ COPD، بیماری انسدادی مزمن ریه؛ IPF، فیبروز ریه ایدیوپاتیک؛ MDS، سندرم میلودیسپلاستیک؛ NAFLD، بیماری کبد چرب غیر الکلی؛ PBC، سیروز صفراوی اولیه؛ PD، بیماری پارکینسون؛ T2D، دیابت نوع ۲.
چشم انداز جاودانگی انسان چیست؟
چشم انداز جاودانگی انسان موضوعی جذاب و بحثبرانگیز است که در سالهای اخیر توجه بسیاری از دانشمندان و پژوهشگران را به خود جلب کرده است. با توجه به پیشرفتهای علمی و پزشکی، بویژه در زمینه های ژنتیک، زیست شناسی مولکولی و فناوریهای سلولی، امید به زندگی انسان بطور قابل توجهی افزایش یافته است.
طول عمر انسان از دهه 1600 بطور قابل توجهی تغییر کرده و از میانگین 30 سال به نزدیک به 79 سال در سال 2012 رسیده است. عواملی که موجب افزایش امید به زندگی انسان شده است، شامل موارد زیر است:
- بهبود شرایط بهداشتی و زیرساختها: ایجاد فاضلاب، دسترسی به آب تصفیه شده و سایر اقدامات بهداشتی؛
- پیشرفتهای پزشکی: نظیر کشف آنتیبیوتیکها و واکسنها؛
- بهبود تغذیه: دسترسی به غذاهای متنوع و مغذی؛
- ارتقا مراقبتهای بهداشتی: بهبود مراقبتهای بهداشتی منجربه کاهش مرگ و میرهای ناشی از بیماریها و مشکلات بهداشتی شده است؛
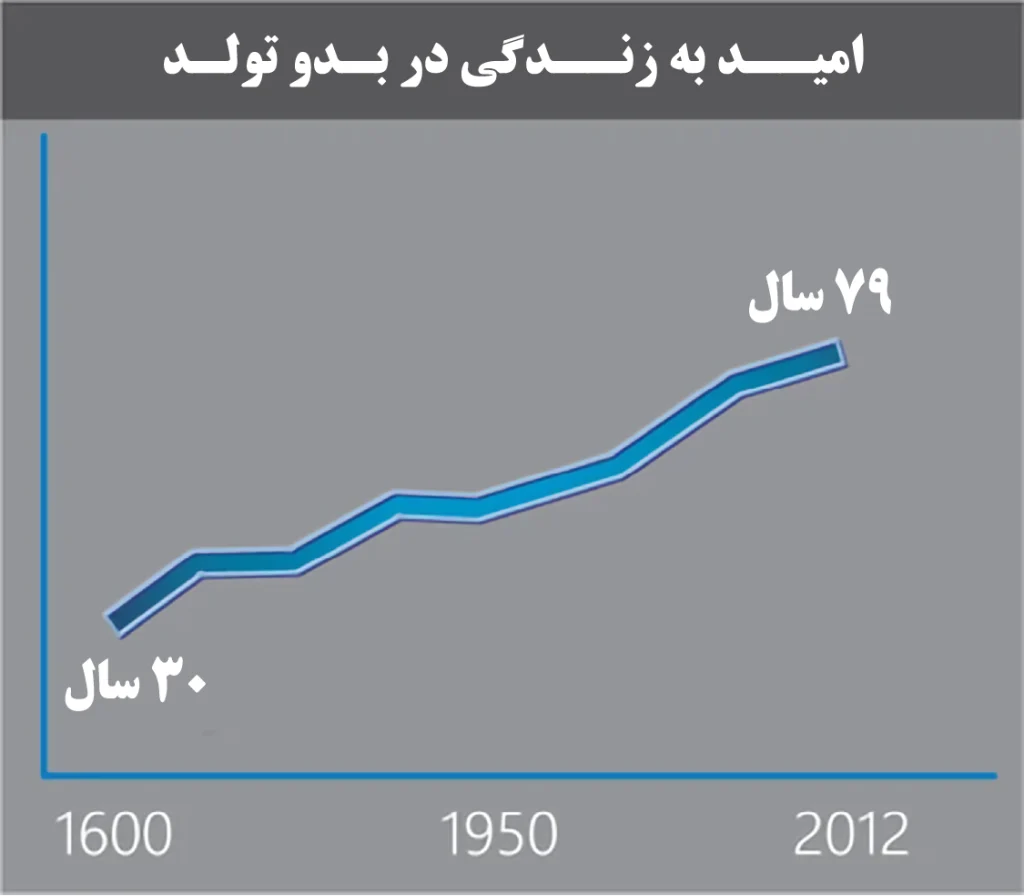
نمودار افزایش امید به زندگی از دهه 1600 تا 2012
برخی دانشمندان معتقدند که امید به زندگی انسان ممکن است همچنان افزایش یابد، اما وجود یک حد بالای طبیعی (بطور تقریبی 90 سال) مورد بحث است. در عوض، برخی دیگر بر این باورند که ممکن است طول عمر انسان بطور چشمگیری افزایش یابد تا جاییکه انسانها قادر به زندگی بسیار بیشتر از 90 سال باشند، اگر بتوانند فرآیندهای پیری و آسیبهای سلولی را درمان کنند.
در این میان، تلومراز بعنوان ابزاری بالقوه برای افزایش طول عمر سلولها مطرح شده است. تلومرها که به مانند محافظهایی در انتهای کروموزومها عمل میکنند، با هر بار تقسیم سلولی کوتاهتر میشوند. تحقیقات نشان داده اند که تلومراز میتواند سلولها را در آزمایشگاه به خوبی تقسیم کند و در عین حال سرطانی نشوند. این یافته ها نویدبخش استفاده از تلومراز برای تولید سلولهای انسانی برای پیوند عضو و درمان بیماریها هستند. بعنوان مثال، میتوان با استفاده از تلومراز:
- سلولهای تولیدکننده انسولین برای درمان دیابت ایجاد کرد؛
- سلولهای ماهیچه ای برای درمان دیستروفی عضلانی ساخت؛
- سلولهای غضروفی برای درمان آرتریت تولید کرد؛
- سلولهای پوستی برای ترمیم زخمها و سوختگیها تهیه کرد؛
این امکان وجود دارد که چشم انداز جاودانگی انسان با پیشرفتهای علمی و پزشکی به واقعیتی ممکن تبدیل شود. با پیشرفتهای بیشتر ممکن است ، نه تنها طول عمر افزایش یابد بلکه کیفیت زندگی نیز بهبود پیدا کند. با اینحال، نیاز به تحقیقات بیشتر و بررسی عواقب به کارگیری تلومراز و تکنیکهای مشابه وجود دارد تا عوارض جانبی، بویژه در زمینه سرطان و سایر بیماریها، بطور مؤثر مدیریت شوند.

