سیتوژنتیک
سیتوژنتیک اساساً شاخه ای از ژنتیک است، اما همچنین بخشی از زیست شناسی سلولی/ سیتولوژی (بخشی از آناتومی انسان) است که به چگونگی ارتباط کروموزومها با رفتار سلولی، به ویژه به رفتار آنها در طول میتوز و میوز مربوط میشود. تکنیکهای مورد استفاده شامل کاریوتایپ، تجزیه و تحلیل کروموزومهای باند G، سایر تکنیکهای باندسازی سیتوژنتیک و همچنین سیتوژنتیک مولکولی مانند هیبریداسیون فلورسانس درجا (FISH) و هیبریداسیون ژنومی مقایسه ای است.
کروموزومها برای اولین بار توسط کارل ناگلی در سال 1842 در سلولهای گیاهی مشاهده شد. رفتار آنها در سلولهای حیوانی (سالامندر) توسط والتر فلمینگ، کاشف میتوز، در سال 1882 توصیف شد. این نام توسط آناتومیست آلمانی دیگری به نام فون والدایر در سال 1888 ابداع شد.
مرحله بعدی پس از توسعه ژنتیک در اوایل قرن بیستم اتفاق افتاد، زمانیکه دریافتند که مجموعه کروموزوم ها (کاریوتیپ) حامل ژنها هستند. به نظر میرسد لویتسکی اولین کسی بود که کاریوتیپ را بهعنوان ظاهر فنوتیپی کروموزومهای سوماتیک، برخلاف محتویات ژنتیکی آنها، تعریف کرد.
بررسی کاریوتایپ انسان سالها طول کشید تا اساسیترین سوال حل شود. یک سلول دیپلوئید طبیعی انسان حاوی چند کروموزوم است؟
مکانیسم تعیین جنسیت. نقاش در سال 1922 مطمئن نبود که آیا تعداد دیپلوئید انسان ها 46 یا 48 است، در ابتدا از 46 حمایت میکرد. او نظر خود را بعداً از 46 به 48 تجدید نظر کرد و به درستی اصرار داشت که انسان ها دارای سیستم تعیین جنسیت XX/XY باشند.
با توجه به تکنیکهای آنها، این نتایج کاملاً قابل توجه بود. در کتابهای علمی، تعداد کروموزومهای انسان برای بیش از سی سال در 48 باقی مانده است. برای اصلاح این خطا به تکنیکهای جدیدی نیاز بود.
- استفاده از سلولها در کشت؛
- قبل از درمان سلولها در محلول هیپوتونیک، که آنها را متورم میکند و کروموزومها را پخش میکند؛
- مهار میتوز در متافاز با محلول کلشی سین؛
- له کردن آماده سازی روی اسلاید باعث میشود کروموزومها به یک صفحه واحد تبدیل شوند؛
- برش فتومیکروگراف و مرتب کردن نتیجه در یک کاریوگرام غیرقابل انکار؛
تا سال 1956 به طور کلی پذیرفته شد که کاریوتیپ انسان فقط شامل 46 کروموزوم است. میمونهای بزرگ دارای 48 کروموزوم هستند. کروموزوم 2 انسان از ادغام کروموزومهای اجدادی تشکیل شد و تعداد آنها کاهش یافت.
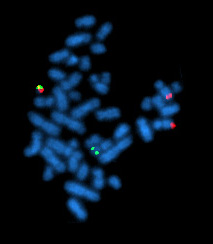

یک سلول متافاز مثبت برای بازآرایی BCR/ABL با استفاده از FISH
ناهنجاریهای انسانی و کاربردهای پزشکی
پس از ظهور روشهایی که امکان شمارش آسان کروموزومها را فراهم میکرد، به سرعت کشفیات مربوط به کروموزومهای نابجا یا تعداد کروموزومها انجام شد.
سیتوژنتیک اساسی: در برخی از اختلالات مادرزادی، مانند سندرم داون، سیتوژنتیک ماهیت نقص کروموزومی را نشان داد: یک تریزومی “ساده”. ناهنجاریهای ناشی از رویدادهای عدم تفکیک میتواند باعث ایجاد سلولهایی با آنئوپلوئیدی (افزودن یا حذف کل کروموزومها) در یکی از والدین یا جنین شود. در سال 1959، Lejeune کشف کرد که بیماران مبتلا به سندرم داون یک نسخه اضافی از کروموزوم 21 دارند. سندرم داون به عنوان تریزومی 21 نیز شناخته میشود.
سایر ناهنجاریهای عددی کشف شده شامل ناهنجاریهای کروموزوم جنسی است. یک زن با تنها یک کروموزوم X دارای سندرم ترنر است، در حالیکه یک مرد با یک کروموزوم X اضافی که منجر به 47 کروموزوم در کل میشود، به سندرم کلاین فلتر مبتلا است.
بسیاری دیگر از ترکیبات کروموزوم جنسی با تولد زنده سازگار هستند، از جمله XXX، XYY، و XXXX. توانایی پستانداران برای تحمل آنوپلوئیدی در کروموزومهای جنسی از توانایی غیر فعال کردن آنها ناشی میشود، که در ماده های طبیعی برای جبران داشتن دو نسخه از کروموزوم لازم است. همه ژنهای کروموزوم X غیرفعال نمیشوند، به همین دلیل است که یک اثر فنوتیپی در افراد با کروموزوم X اضافی مشاهده میشود.
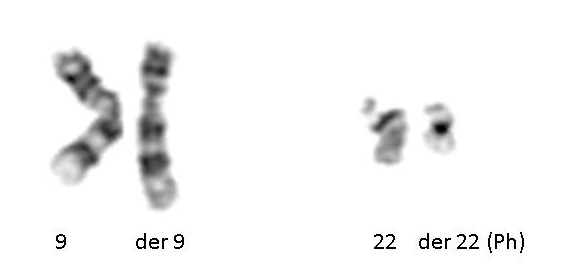
سیتوژنتیک اکتسابی: در سال 1960، پیتر ناول و دیوید هانگرفورد یک کروموزوم کوچک در گلبولهای سفید خون بیماران مبتلا به لوسمی میلوژن مزمن (CML) کشف کردند. این کروموزوم غیرطبیعی کروموزوم فیلادلفیا نام گرفت – زیرا هر دو دانشمند در حال انجام تحقیقات خود در فیلادلفیا، پنسیلوانیا بودند.
سیزده سال بعد، با توسعه تکنیکهای پیشرفته تر، کروموزوم غیر طبیعی توسط جانت رولی نشان داد که نتیجه جابجایی کروموزومهای 9 و 22 است. شناسایی کروموزوم فیلادلفیا توسط سیتوژنتیک برای CML تشخیصی است. بیش از 780 لوسمی و صدها تومور جامد (ریه، پروستات، کلیه و غیره) در حال حاضر با یک ناهنجاری کروموزومی اکتسابی مشخص میشوند که ارزش پیش آگهی آن بسیار مهم است.
شناسایی این ناهنجاریهای کروموزومی منجر به کشف تعداد بسیار زیادی از “ژنهای سرطانی” (یا انکوژنها) شده است. دانش روزافزون این ژنهای سرطانی اکنون امکان توسعه درمانهای هدفمند را فراهم میکند که چشمانداز بقای بیمار را تغییر میدهد. بنابراین، سیتوژنتیک نقش اساسی در پیشرفت درک سرطان داشته و دارد. پایگاه های اطلاعاتی بزرگ (اطلس ژنتیک و سیتوژنتیک در انکولوژی و هماتولوژی، پایگاه داده سرطان کیهان، پایگاه داده Mitelman انحرافات کروموزومی و همجوشی ژن در سرطان) به محققان و پزشکان این امکان را میدهد که مجموعه لازم را برای کار خود در این زمینه داشته باشند.
انتقال فیلادلفیا در لوسمی میلوژن مزمن مشاهده میشود.
ظهور تکنیکهای باندبندی
در اواخر دهه 1960، Torbjörn Caspersson یک تکنیک رنگآمیزی فلورسنت کوئیناکرین (Q-banding) را توسعه داد که الگوهای نواری منحصربفردی را برای هر جفت کروموزوم نشان داد.
این باعث شد جفتهای کروموزوم با اندازههای مشابه با الگوهای نوار افقی متمایز متمایز شوند. الگوهای نواری اکنون برای روشن کردن نقاط شکست و کروموزوم های تشکیل دهنده درگیر در جابجایی کروموزوم استفاده میشود.
حذفها و وارونگیها در یک کروموزوم فردی نیز میتوانند با استفاده از نامگذاری باند استاندارد شناسایی و توصیف شوند. G-banding (با استفاده از تریپسین و رنگ آمیزی گیمسا/رایت) بطور همزمان در اوایل دهه 1970 توسعه یافت و امکان تجسم الگوهای نواری را با استفاده از یک میکروسکوپ میدان روشن فراهم میکند.
نمودارهایی که کروموزومها را براساس الگوهای باندی شناسایی میکنند به عنوان ایدیوگرام شناخته میشوند. این نقشهها مبنایی برای زمینههای قبل از تولد و انکولوژیک شد تا به سرعت سیتوژنتیک را به آزمایشگاه بالینی منتقل کنند، جاییکه کاریوتایپ به دانشمندان اجازه میدهد به دنبال تغییرات کروموزومی باشند. تکنیکها برای امکان کشت آمنیوسیتهای آزاد بازیابی شده از مایع آمنیوتیک و تکنیکهای افزایش طول برای همه انواع کشت که امکان نواربندی با وضوح بالاتر را فراهم میکند، گسترش یافت.


کاریوگرام میکرووگرافی یک مرد.
تکنیکها
آنالیز معمول کروموزوم (Karyotyping) به تجزیه و تحلیل کروموزومهای متافازی اشاره دارد که با استفاده از تریپسین به دنبال آن گیمسا، لیشمان یا مخلوطی از این دو نواربندی شده اند. این باعث ایجاد الگوهای نواری منحصر به فرد بر روی کروموزوم ها میشود. مکانیسم مولکولی و دلیل این الگوها ناشناخته است، اگرچه احتمالاً مربوط به زمان همانند سازی و بسته بندی کروماتین است.
چندین تکنیک باندبندی کروموزوم در آزمایشگاه های سیتوژنتیک استفاده میشود. باندینگ کوئیناکرین (Q-banding) اولین روش رنگ آمیزی بود که برای تولید الگوهای نواری خاص مورد استفاده قرار گرفت. این روش به میکروسکوپ فلورسنت نیاز دارد و دیگر به اندازه باندینگ گیمسا (G-banding) کاربرد ندارد. باند معکوس یا R-banding نیاز به عملیات حرارتی دارد و الگوی سیاه و سفید معمولی را که در باندهای G و باند Q دیده میشود معکوس میکند. این روش بویژه برای رنگ آمیزی انتهای دیستال کروموزوم ها مفید است. سایر تکنیکهای رنگآمیزی شامل C-banding و لکههای ناحیه سازماندهنده هستهای (لکههای NOR) است. این روش های اخیر بطور خاص بخشهای خاصی از کروموزوم را رنگ آمیزی میکنند. C-banding هتروکروماتین سازنده را که معمولاً در نزدیکی سانترومر قرار دارد رنگ میکند و رنگآمیزی NOR ماهوارهها و ساقههای کروموزومهای آکروسانتریک را برجسته میکند.
نواربندی با وضوح بالا شامل رنگ آمیزی کروموزوم ها در طول پروفاز یا متافاز اولیه (پرومتافاز)، قبل از رسیدن به حداکثر متراکم میشود. از آنجایی که کروموزومهای پروفاز و پرومتافاز گستردهتر از کروموزومهای متافاز هستند، تعداد باندهای قابل مشاهده برای همه کروموزومها (باند در هر مجموعه هاپلوئید، bph؛ “سطح باند”) از حدود 300 به 450 به 800 افزایش مییابد. این امکان تشخیص ناهنجاریهای کمتر آشکار معمولاً با نواربندی معمولی دیده نمیشوند.
هیبریداسیون درجا فلورسانس (FISH) به استفاده از پروب نشاندار شده با فلورسنت برای هیبریداسیون با آماده سازی سلولهای سیتوژنتیک اشاره دارد.
علاوه بر آماده سازی استاندارد، FISH همچنین می تواند در موارد زیر انجام شود:
- اسمیر مغز استخوان؛
- اسمیر خون؛
- آماده سازی بافت پارافین جاسازی شده؛
- نمونه های بافت آنزیمی جدا شده؛
- مغز استخوان کشت نشده؛
- آمنیوسیتهای کشت نشده؛
- آماده سازی سیتوسپین؛
آینده سیتوژنتیک
پیشرفتها اکنون بر روی سیتوژنتیک مولکولی از جمله سیستمهای خودکار برای شمارش نتایج آمادهسازی استاندارد FISH و تکنیکهای کاریوتایپینگ مجازی، مانند آرایههای هیبریداسیون ژنومی مقایسهای، CGH و آرایههای پلیمورفیسم تک نوکلئوتیدی تمرکز دارد.
