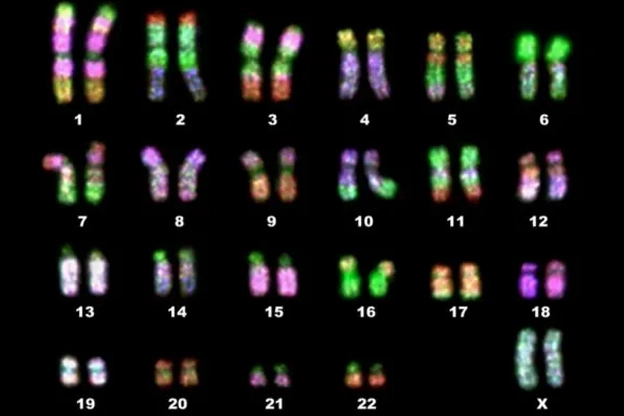
سیتوژنتیک: گذشته، حال و آینده
سیتوژنتیک (cytogenetics) شاخهای از ژنتیک است که به طور خاص به مطالعه کروموزومها، ساختار، عملکرد و ناهنجاریهای آنها میپردازد. به عبارت دیگر، سیتوژنتیک شامل تجزیه و تحلیل کروموزومها در سطح میکروسکوپی برای درک تغییرات ژنتیکی، مانند بازآرایی کروموزومی، حذف، تکرار و سایر ناهنجاریهایی است که میتواند با اختلالات و بیماریهای ژنتیکی مرتبط باشد.
تکنیکهای سیتوژنتیک با تجزیه و تحلیل تعداد و ساختار کروموزومها در سلولها به منظور تشخیص بیماریهای ژنتیکی، مطالعه تنوع ژنتیکی و کشف رابطه بین ناهنجاریهای کروموزومی و بیماریها مورد استفاده قرار میگیرند.
بیش از پنجاه سال از کشف تعداد کروموزومهای انسانی در سال 1956 میگذرد. از آن زمان تاکنون تکنیکهای جدیدتری توسعه یافتهاند، از تکنیکهای باندینگ اولیه تا هیبریداسیون ژنومی مقایسهای آرایهی مولکولی که در حال حاضر استفاده میشوند، از جمله روشهای مطالعات کروموزومی به شمار میآیند.
با به کارگیری انواع تکنیکهای مرسوم مولکولی، سیتوژنتیک به ابزاری ضروری برای تشخیص اختلالات ژنتیکی مختلف تبدیل شده، از این رو، راهی برای درمان و مدیریت احتمالی اختلالات کروموزومی ایجاد کرده است. در این مقاله قصد داریم تاریخچه و روند تکامل سیتوژنتیک را تا وضعیت فعلی این فناوری، مورد بررسی قرار دهیم.
تاریخچه سیتوژنتیک
سیتوژنتیک دارای تاریخچه غنی است که در طول زمان با توسعه تکنیکهای علمی و پیشرفت در ژنتیک تکامل یافته است. در اینجا مروری کوتاه بر تاریخچه سیتوژنتیک خواهیم داشت:
مشاهدات اولیه
شروع مطالعات سیتوژنتیک به اواخر قرن نوزدهم بازمیگردد، زمانی که دانشمندان برای اولین بار شروع به مشاهده کروموزومها در زیر میکروسکوپ کردند. در سال 1882، زیست شناس آلمانی، والتر فلمینگ، اصطلاح (کروماتین) را برای توصیف ساختارهایی که در هستههای سلولی دید، ابداع کرد و در این زمان پایه و اساس مطالعه کروموزومها تشکیل شد.
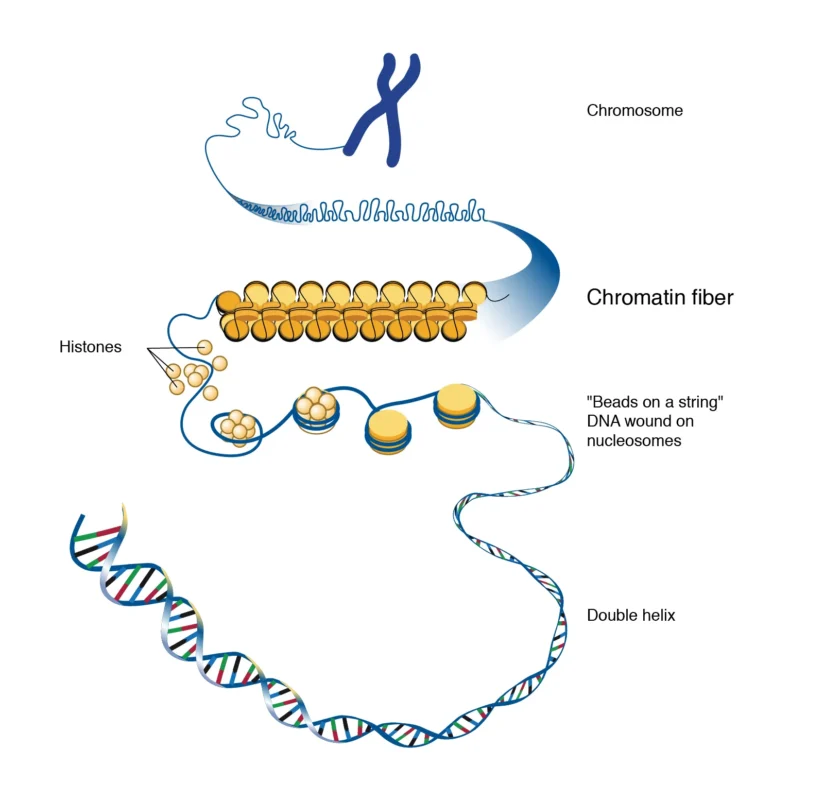
در سال 1888، هاینریش والدایر (Waldeyer ) دانشمند آلمانی اصطلاح ((کروموزوم)) را پس از ایجاد تکنیکهای رنگ آمیزی برای تشخیص بیشتر کروموزومها (کروموس = کلمه یونانی به معنی رنگ، سوما = کلمه یونانی به معنی بدن) ابداع کرد.
دانشمندانی مانند تئودور بووری، والتر ساتون و توماس هانت مورگان در اوایل قرن بیستم سهم قابل توجهی در زمینهی سیتوژنتیک داشتند. مطالعات بووری روی تخمهای خارپشت دریایی و کار ساتون روی ملخها به ایجاد ارتباط بین کروموزومها و وراثت کمک کرد.
کشف کروموزومها
اوایل قرن بیستم با کشف کروموزومها به عنوان حامل اطلاعات ژنتیکی، پیشرفتهای قابل توجهی در سیتوژنتیک به دست آمد. در سال 1902، تئودور بووری و والتر ساتون هر یک به طور جداگانه پیشنهاد کردند که کروموزومها مسئول انتقال صفات ارثی هستند. از طریق استفاده از میکروسکوپ و تکنیکهای رنگ آمیزی، محققان توانستند تعداد طبیعی کروموزومها را در سلولهای انسانی تعیین کنند و ساختار آنها از جمله شناسایی بازوها، نوارها و سانترومرهای کروموزومی مورد مطالعه قرار گرفت.

تعیین تعداد کروموزومها
در ابتدا، تعیین تعداد دیپلوئید گونههای پستانداران دشوار بود. این امر، به این دلیل بود که کروموزومها در مرحله متافاز به صورت نامرتب و درهم قرار میگرفتند. در دهه 1950، پیشرفتهای فنی در زمینه مطالعات سلولی مانند افزودن کلشیسینها (colchicines) برای مهار سلولها در متافاز و استفاده از محلول هیپوتونیک برای به دست آوردن گسترش بهتر کروموزوم، انجام شد.
در سال 1956، تعداد دیپلوئید کروموزومها در انسان 46 تعیین شد و روش کشت لکوسیت محیطی مورهد (Moorehead) توسط بسیاری از دانشمندان سیتوژنتیک مورد پذیرش قرار گرفت.
پس از این مطالعات، دانشمندان قادر بودند به درستی تعداد کروموزوم طبیعی انسان و ناهنجاریهای کروموزومی را توصیف کنند. این امکان، تشخیص انحرافات عددی کروموزوم، مانند تریزومی 21 در سندرم داون، (45، X) در سندرم ترنر، (47، XXY) در سندرم کلاین فلتر، تریزومی 13، تریزومی 18 و کروموزوم فیلادلفیا در بیماران مبتلا به لوسمی میلوئیدی مزمن را تسهیل کرد.
علاوه بر این، در این زمان گزارشهایی به دست آمد مبنی بر این که از سلولهای کشت شده از مایع آمنیوتیک (amniotic fluid ) میتوان برای تعیین محتوای کروموزوم جنین استفاده کرد.
کروموزومهای متافاز براساس طبقه بندی دنور (Denver classification) (1960)، به هفت گروه طبقه بندی شدند. جاو هونگ کائو، یک مدل از طبقه بندی کروموزوم را نیز براساس شباهت مشخصات باند در امتداد محور داخلی تقریبی توصیف کرد
توسعه تکنیکهای رنگآمیزی
توسعه تکنیکهای رنگآمیزی، دانشمندان را قادر ساخت تا کروموزومها را واضحتر مورد مشاهده قرار دهند و ساختار و تعداد آنها را مطالعه کنند. به عنوان مثال، کشف تکنیکهای نواربندی کروموزوم، مانند G-banding توسط Caspersson و Zech در دهه 1970، امکان مشاهده الگوهای متمایز روی کروموزومها را فراهم کرد و به شناسایی نواحی کروموزومی و ناهنجاریهای خاص کمک کرد.
تولد سیتوژنتیک بالینی
شاخهای از سیتوژنتیک تحت عنوان سیتوژنتیک بالینی در اواسط قرن بیستم با استفاده از تکنیکهای سیتوژنتیک برای تشخیص اختلالات ژنتیکی و ناهنجاریهای کروموزومی در انسان به وجود آمد. این امر منجر به تأسیس آزمایشگاههای سیتوژنتیک برای آزمایشها و تحقیقات بالینی شد. سیتوژنتیک بالینی در شناسایی ناهنجاریهای کروموزومی مرتبط با اختلالات ژنتیکی مانند سندرم داون، سندرم ترنر و سندرم کلاین فلتر اهمیت بسزایی دارد.
پیشرفتها در سیتوژنتیک مولکولی و کاربرد آن در تحقیقات سرطان
در اواخر قرن بیستم، تکنیکهای سیتوژنتیک مولکولی، مانند هیبریداسیون فلورسانس درجا (FISH) و هیبریداسیون ژنومی مقایسهای (CGH)، با امکان تجزیه و تحلیل دقیقتر ناهنجاریهای کروموزومی در سطح مولکولی، انقلابی در این زمینه ایجاد کرد. تجزیه و تحلیل سیتوژنتیک با آشکار ساختن ناهنجاریهای کروموزومی در سلولهای تومور، نقش مهمی در تحقیقات سرطان ایفا کرده است. به طوری که تکنیکهایی مانند کاریوتایپ طیفی (SKY) و هیبریداسیون فلورسانس در محل (FISH) برای شناسایی تغییرات ژنتیکی در سرطانها و هدایت تصمیمات درمانی استفاده میشود.
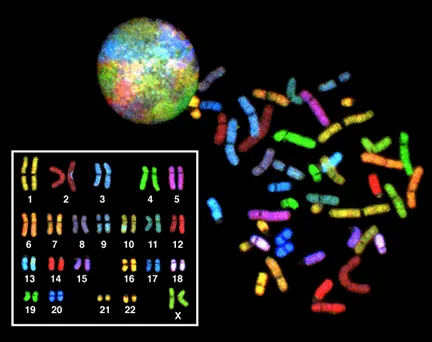
فناوریهای ژنومی و پروژه ژنوم انسان
با ظهور فناوریهای ژنومی و توالییابی با توان عملیاتی بالا، سیتوژنتیک گسترش یافت و با به کارگیری تجزیه و تحلیل کل ژنوم، توالی یابی نسل جدید و ابزارهای بیوانفورماتیک، فناوری سیتوژنتیک نقش کلیدی در پروژه ژنوم انسانی ایفا کرد که هدف آن نقشه برداری و توالی یابی کل ژنوم انسان بود. نتیجه پروژه ژنوم انسانی، شامل تجزیه و تحلیل سیتوژنتیک کروموزومها برای شناسایی ژنها و تغییرات ژنتیکی بود.
به طور کلی، تاریخچه سیتوژنتیک تکامل آن را از مشاهدات اولیه کروموزومها تا توسعه تکنیکهای پیچیده برای مطالعه مواد ژنتیکی و شناسایی ناهنجاریهای کروموزومی مرتبط با بیماریهای ژنتیکی در بر میگیرد. امروزه، سیتوژنتیک همچنان نقش حیاتی در تحقیقات، تشخیص بالینی و درک اساس ژنتیکی اختلالات مختلف ایفا میکند.
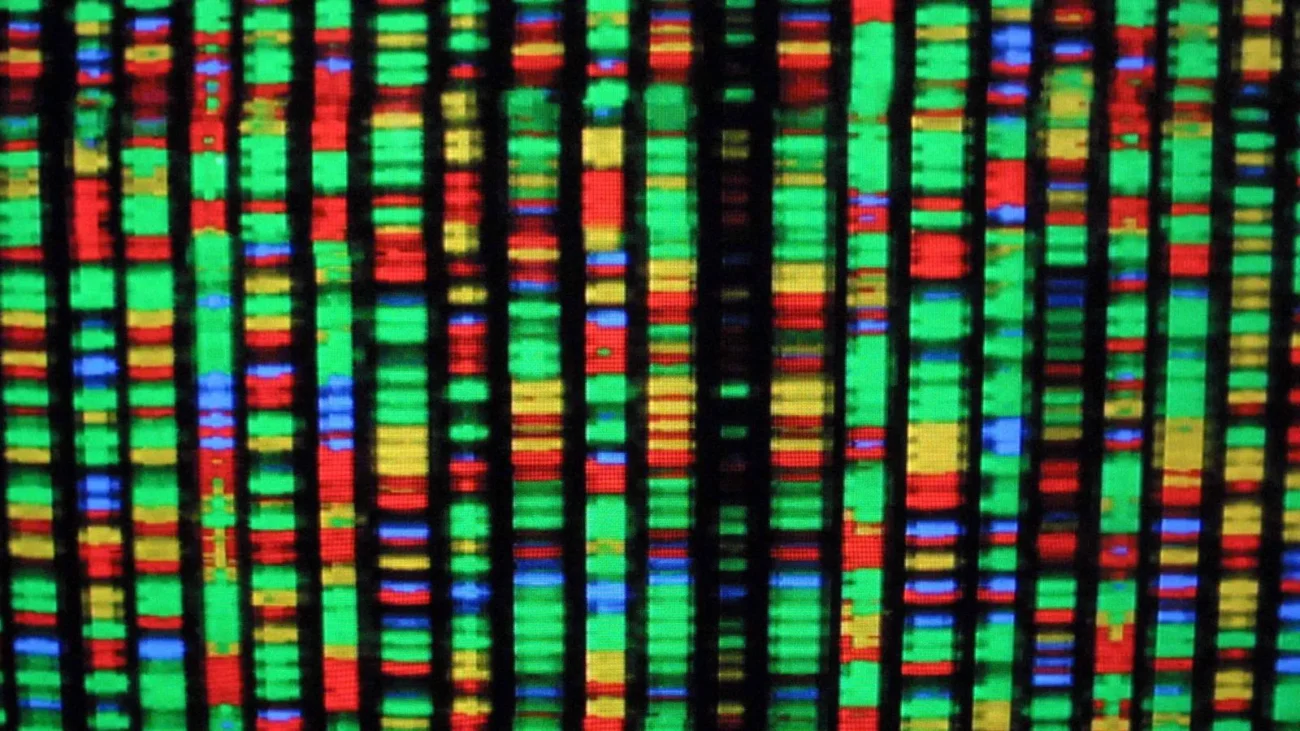
ظهور تکنیکهای باندینگ در سیتوژنتیک
ظهور تکنیکهای باندینگ در سیتوژنتیک، پیشرفت قابلتوجهی بوده که با امکان مشاهده و تجزیه و تحلیل کروموزومها در سطحی دقیقتر، انقلابی در این زمینه ایجاد کرده است.
توسعه تکنیکهای باندینگ در سیتوژنتیک به دهه 1970 برمیگردد، زمانی که محققان برای اولین بار، روشهایی را برای ایجاد نوارهای قابل مشاهده بر روی کروموزومها کشف کردند. تکنیکهای مختلف باندبندی، مانند G-banding، Q-banding، R-banding، C-banding و غیره، برای آشکار کردن الگوها و ساختارهای منحصر به فرد روی کروموزومها توسعه یافتند.
Q-سbanding
کاسپرسون و همکارانش یکی از اولین تکنیکهای باندینگ کروموزومی به نام (Q-banding) را ابداع کردند که در این تکنیک رنگ آمیزی کروموزومها با استفاده از فلوئوروکرومهایی مانند کیناکرین خردل یا دی هیدروکلراید کویناکرین انجام میشود و بررسی آنها با میکروسکوپ فلورسانس صورت میگیرد. با این حال، این تکنیک برای مطالعات معمول کمتر از حد مطلوب و بهینه بود، زیرا رنگآمیزی فلورسنت به سرعت خاموش میشدند. از این رو، چندین تکنیک باندینگ دیگر توسعه یافتند، به عنوان مثال، تکنیکها باندینگ G-، R-، -C و NOR که هر کدام خواص و کاربردهای خاص خود را دارند.
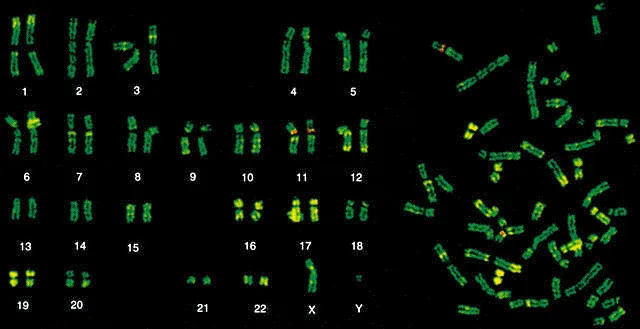
G-banding
G-banding که مخفف Giemsa Banding است، یکی از پرکاربردترین تکنیکهای باندبندی در سیتوژنتیک به شمار میآید. این تکنیک شامل رنگ آمیزی کروموزومها با رنگ گیمسا و سپس استفاده از میکروسکوپ برای شناسایی نوارهای روشن و تاریک متمایز بر روی کروموزومها است. این تکنیک رزولوشن بهتری از Q-banding ارائه داد و امکان آماده سازی دائمی را ایجاد کرد و نیازی به استفاده از میکروسکوپ فلورسانس نداشت. G-banding معمولاً در سیتوژنتیک بالینی برای تجزیه و تحلیل ساختار کروموزومی و شناسایی ناهنجاریها استفاده میشود.

C-banding
Pardue و Gall اولین بار در سال 1970 ایجاد باندها یا نوارهای C را گزارش کردند، آن زمان، آنها کشف کردند که ناحیه سانترومری کروموزومهای موش غنی از توالیهای DNA تکراری است و با رنگ آمیزی با Giemsa به رنگ تیره در میآید. نوارهای C در نواحی هتروکروماتیک کروموزومها قرار میگیرند. بسیاری از کروموزومها دارای مناطقی هستند که در بین افراد متفاوت است اما هیچ اهمیت پاتولوژیکی ندارند. این نواحی چند شکلی را میتوان با روشهای باند C به طور بهینه مشاهده کرد.
تکنیک C-banding همچنین برای نشان دادن کروموزومهای دارای سانترومرهای متعدد، مطالعه منشأ حاملگیهای مولار دیپلوئید (diploid molar pregnancies) و هرمافرودیتیسم واقعی (true hermaphroditism) و تمایز بین سلولهای دهنده و گیرنده در پیوند مغز استخوان مفید بوده و مورد استفاده قرار میگیرد.

NOR
باندینگ ناحیه سازماندهی هسته ای (NOR) تکنیکی است که در آن NORهای کروموزومها مورد رنگ آمیزی قرار میگیرند. این نواحی در ساقههای ماهوارهای کروموزومهای آکروسنتریک و محل ژنهای RNA ریبوزومی قرار دارند. Goodpasture و همکارانش یک تکنیک ساده رنگ آمیزی نیترات نقره را برای NOR-banding ایجاد کردند که در عمل بالینی برای مطالعه چند شکلیهای کروموزومی خاص، مانند ماهوارههای دوگانه مفید است.
سیتوژنتیک با وضوح بالا
با وجود توسعه تکنیکهای باندینگ، وضوح مطالعات کروموزومی در حد نسبتا محدودی باقی ماند، زیرا تعداد کل نوارهای تولید شده روی کروموزومهای متافاز کم بود و تشخیص بازآراییهای مربوط به بخشهای کوچکی از کروموزومها به دلیل تراکم بسیار بالا به سختی قابل انجام بود. این مشکلات با توسعه باندینگ با وضوح بالا مرتفع شد که با هماهنگ سازی کشتهای لنفوسیتی و به دست آوردن سلولهای بیشتر در پرومتافاز یا حتی پروفاز به دست آمد.
سیتوژنتیک با وضوح بالا (High resolution cytogenetics) به محققان اجازه میدهد، کروموزومها را در سطح ژنهای منفرد و توالیهای DNA مطالعه کنند. این تجزیه و تحلیل دقیق، تشخیص ناهنجاریهای کروموزومی ظریفی را که ممکن است از طریق میکروسکوپ معمولی قابل مشاهده نباشند، امکان پذیر کرده است.
با استفاده از این تکنیک مشخص شد که چندین سندرم بالینی شناخته شده مانند سندرمهای پرادر ویلی (Prader-Willi) و آنجلمن (Angelman) با حذف در بازوی بلند پروگزیمال کروموزوم 15، سندرمهای اسمیت – مگنیس (Smith-Magenis) و میلر- دیکر (Miller-Dieker ) با حذف (متفاوت) در بازوی کوتاه کروموزوم 17 و سندرمهای DiGeorge/Velo Cardio Facial (VCF) با حذف در بازوی بلند کروموزوم 22، میتوانند به انحرافات کروموزومی کوچک مرتبط باشند و به این ترتیب، مفهوم سندرم ریزحذف یا ژن مجاور ایجاد شد.
تکنیکهای باندینگ تحقیقات در زمینههای مختلف ژنتیک از جمله سیتوژنتیک سرطان، زیست شناسی رشد، مطالعات تکاملی و نقشه برداری ژن را تسهیل کرده است. به این ترتیب، توانایی مشاهده و تجزیه و تحلیل کروموزومها در سطح دقیق، به درک بهتر مکانیسمهای ژنتیکی و بیماریها کمک میکند.
به طور کلی، ظهور تکنیکها باندینگ در سیتوژنتیک تأثیر عمیقی بر توانایی دانشمندان برای مطالعه کروموزومها، شناسایی ناهنجاریهای ژنتیکی و پیشرفت دانش در مورد ژنتیک و زیست شناسی کروموزومی داشته است. این تکنیکها همچنان ابزارهای ضروری در تحقیقات و عمل بالینی در زمینه سیتوژنتیک به شمار میآیند.
تکنیکهای سیتوژنتیک برای مشاهده کروموزومها
تکنیکهای سیتوژنتیک تخصصی برای مشاهده جزئیات ساختار و عملکرد کروموزومها مورد استفاده قرار میگیرند. برخی از این تکنیکها عبارتند از:
1. کاریوتایپینگ (Karyotyping):
این تکنیک شامل رنگ آمیزی و مشاهده کروموزومها در زیر میکروسکوپ برای بررسی ساختار، تعداد و هرگونه ناهنجاری ژنی است. به طور کلی، کاریوتایپینگ یک روش آزمایشگاهی محسوب میشود که برای تحلیل ساختار کروموزومها مورد استفاده قرار میگیرد. تکنیک کاریوتایپ با مطالعه شماره، اندازه، شکل و ترتیب کروموزومهای یک سلول در شرایط خاص انجام میشود. در این روش معمولاً از نمونهای از سلولهای بدنی یا سلولهای جنینی به منظور انجام کاریوتایپینگ استفاده میشود.
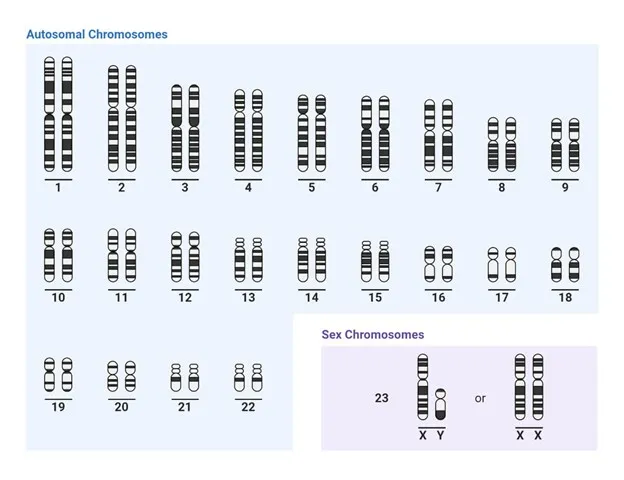
در کاریوتایپینگ، سلولها ابتدا تقسیم شده و روی یک لام فیکس میشوند و پس از رنگ آمیزی تحت بررسی با میکروسکوپ قرار میگیرند. با استفاده از میکروسکوپ، کروموزومها به صورت جفت جفت مشاهده شده و مورد ارزیابی قرار میگیرند. اطلاعات به دست آمده از کاریوتایپینگ میتواند به تشخیص اختلالات ژنتیکی، اختلالات کروموزومی، بیماریهای ژنتیکی و انجام تستهای پیش از تولد کمک کند.
2. هیبریداسیون درجا فلورسانس FISH :
در سال 1986، پینکل و همکارانش روشی را برای مشاهده کروموزومها توسعه دادند. این روش با به کارگیری پروبهای نشاندار شده با فلورسنت، هیبریداسیون درجا فلورسنت (fluorescent in situ hybridization) یا (FISH) نام گرفت. تکنیک FISH به گونه ای عمل میکند که امکان شناسایی توالیهای خاص اسید نوکلئیک را در کروموزومها، سلولها و بافتهای حفاظت شده مورفولوژیکی فراهم میکند.
FISH تکنیک سیتوژنتیک مولکولی پرکاربردی است که از پروبهای DNA نشاندار شده با فلورسنت برای اتصال به توالیهای DNA خاص روی کروموزومها استفاده میکند. با مشاهده مکان و تعداد سیگنالهای پروب روی کروموزومها، FISH میتواند ناهنجاریهای کروموزومی، تکثیر ژنها، حذفها و جابهجاییها را به صورت هدفمند تشخیص دهد.
از تکنیک FISH میتوان برای تعیین ترتیب کلونهای DNA نسبت به باندها، نقاط شکست طبیعی و سایر کلونها استفاده کرد. به این ترتیب، مکان و موقعیت دقیق DNA در کروموزومها را تعیین کرد. مهمترین کاربرد تکنیک FISH این است که امکان تجزیه و تحلیل کاریوتیپ هستهها در سلولهای غیرقابل تقسیم را فراهم میکند.
3. هیبریداسیون مقایسهای ژنومی CGH:
تحقیقات بر پایه تکنیک FISH از جنبههای مختلف بسیار سودمند به شمار میآیند. این در حالی است که به کارگیری این تکنیکها زمانبر هستند، زیرا پروبهای آماده شده در این تکنیک باید هیبرید شوند و سپس به صورت میکروسکوپی مورد تجزیه و تحلیل قرار گیرند. این مشکلات موجب شد تا محققان تکنیک دیگری را از تکنیک اولیه FISH توسعه دهند که به عنوان تکنیک هیبریداسیون مقایسهای ژنومی (Comparative Genomic Hybridization) یا CGH شناخته میشود. در مطالعات بعدی، آرایههای مبتنی بر هیبریداسیون ژنومی مقایسهای، به منظور توسعه بیشتر این تکنیک ایجاد شد.
CGH براساس اصل مقایسه DNA ژنومی یک نمونه آزمایشی ( یک نمونه تومور) با یک نمونه مرجع ( DNA ژنومی طبیعی) انجام میشود. در این تکنیک، نمونه مورد آزمایش و DNA مرجع با رنگهای فلورسنت مختلف برچسبگذاری میشوند. سپس با کروموزومهای متافاز معمولی یا اسلایدهای ریزآرایه هیبرید میشوند.
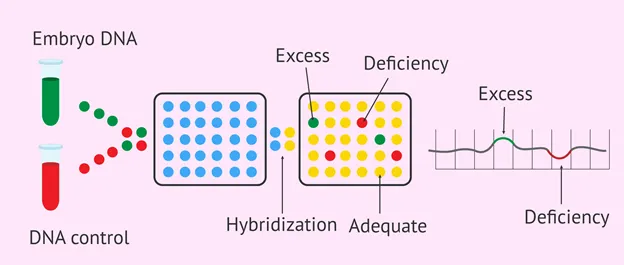
با اندازه گیری شدت فلورسانس نسبی نمونه و پروب DNA مرجع کروموزومها، CGH میتواند مناطقی از ژنوم که توالیهای DNA به دست آورده یا از دست دادهاند را شناسایی کند. به این ترتیب، این امکان را برای تشخیص تغییرات تعداد کپی، حذف، تکرار و تکثیر در نمونه آزمایشی فراهم میکند.
در سیتوژنتیک بالینی، CGH به ابزاری ارزشمند برای تشخیص اختلالات ژنتیکی و ناهنجاریهای کروموزومی در بیماران تبدیل شده است. تجزیه و تحلیل CGH میتواند عدم تعادل ژنومی مرتبط با شرایط ژنتیکی مانند اختلالات رشدی، ناتوانیهای ذهنی و ناهنجاریهای مادرزادی را شناسایی کند.
آرایه CGH
روش آرایه CGH نیازی به تهیه کروموزومهای متافاز از سلولها ندارد. به جای هیبرید کردن یک کاوشگر نشاندار به کروموزومهای انسانی، اکنون میتوان هزاران کاوشگر مختلف و با اختصاصیت بالا را روی یک اسلاید شیشهای پرینت کرد یا قرار داد. آرایه CGH کارایی بهتری از CGH معمولی ارائه میدهد.
کاری که آرایه CGH انجام میدهد را میتوان معادل انجام هزاران آزمایش FISH به طور همزمان در نظر گرفت. همچنین نسبت به CGH معمولی، کمیت بهتری از نظر تعداد کپی و اطلاعات دقیقتری در مورد نقاط شکست بخشهایی که از دست میروند یا به دست میآیند، ارائه میدهد. به عبارتی دیگر ،این تکنیک نسبت به ابزارهای سیتوژنتیک مولکولی موجود، عملکرد سریعتر و وضوح بهتری دارد.
به طور کلی، CGH با ارائه یک ابزار قدرتمند برای شناسایی عدم تعادل کروموزومی و تغییرات تعداد کپی در تحقیقات و تنظیمات بالینی، سیتوژنتیک را متحول کرده است. وضوح بالا و تجزیه و تحلیل جامع ژنومی این روش، CGH را به یک تکنیک ضروری در مطالعه اختلالات ژنتیکی، ژنتیک سرطان و بیولوژی کروموزومی تبدیل کرده است.
4. کاریوتایپ طیفی(SKY):
کاریوتایپینگ طیفی (SKY) یک تکنیک سیتوژنتیک مولکولی به شمار می آید. این روش امکان مشاهده همزمان همه کروموزومها را (هر کروموزوم با رنگ منحصر به فرد) فراهم میکند. تکنیک SKY در سال 1996 توسعه یافت. این روش شامل هیبریداسیون پروبهای FISH مخصوص کروموزوم است که با فلوئوروکرومهای (Fluorochromes) مختلف یا ترکیبی از فلوئوروکرومها برچسبگذاری شدهاند. این روش، امکان تشخیص هر یک از 23 جفت کروموزوم انسانی را فراهم میکند. کروموزومهای رنگ آمیزی شده در تکنیک SKY توسط میکروسکوپ فلورسانس قابل مشاهده میشود. این میکروسکوپ در ارتباط با یک سیستم تصویربرداری تخصصی و تکنیکهای پیشرفته تجزیه و تحلیل دادهها برای بازسازی اطلاعات طیفی مورد استفاده قرار میگیرد.
با رنگ آمیزی کروموزومها به رنگهای مختلف در کاریوتایپ طیفی، میتوان انحرافات کروموزومی را به آسانی تشخیص داد. انحرافات کروموزومی ممکن است به صورت قطعات کروموزوم از دست رفته یا اضافی و کروموزومهایی که چندین رنگ را نشان میدهند، ظاهر شوند.
تکنیک SKY مشاهده کروموزومهای منفرد را در سلولهای متافاز یا اینترفاز ممکن میسازد. همچنین تشخیص ناهنجاریهای کروموزومی ظریف، مانند کروموزومهای نشانگر، جابهجاییهای کوچک، بازآراییهای پیچیده و نقصهای ساختاری جزئی را با حساسیت و اختصاصیت بالا بهبود میبخشد. از این رو، SKY به یک ابزار ارزشمند در زمینههای مختلف سیتوژنتیک و سیتولوژی که در آنها روشهای سنتی باندینگ دقت کافی را ارائه نمیدهند، تبدیل شده است.
5. تجزیه و تحلیل ریزآرایه کروموزومی (CMA):
تکنیک CMA به عنوان یکی از تکنیکهای پیشرفته سیتوژنتیک شناخته میشود که اصول CGH را با فناوری ریزآرایه ترکیب میکند. CMA امکان تجزیه و تحلیل با توان بالا را از تغییرات تعداد کپی DNA در هزاران مکان ژنومی به طور همزمان فراهم میکند. همچنین وضوح و حساسیت بیشتری را در مقایسه با CGH معمولی ارائه میدهد. این روش قابلیت تفکیک و تجزیه و تحلیل بیش از یک میلیون نقطه DNA در یک نمونه زیستی را دارد.
در این تکنیک، نمونه DNA، معمولاً از خون، بافت یا سایر نمونههای بیولوژیکی تهیه میشود. نمونه سپس روی یک آرایه شیشهای که حاوی نقاط DNA است، قرار میگیرد. در مرحله بعد، با استفاده از دستگاه آنالیز، از نقاط DNA که دربردارنده ی میلیونها پروب DNA است میتوان به صورت همزمان میزان DNA موجود در نمونه در هر نقطه آرایه را اندازهگیری کرد.
با تحلیل دادههای به دست آمده از CMA، تغییرات ساختاری و ناهنجاری در کروموزومها، مانند حذف و اضافهها یا افزایش و کاهش تعداد نسخههای خاص از یک بخش DNA، مشخص میشود. این روش مفید در تشخیص بیماریهای ژنتیکی، اختلالات مادرزادی، ناباروری و در بررسی موازیسمها مورد استفاده قرار میگیرد.
6. مرتب سازی سلولی فعال شده با فلورسانس (FACS) و مرتبسازی کروموزوم:
FACS در کنار سایر تکنیکها سیتوژنتیک مولکولی امکان جداسازی و مرتب سازی کروموزومها یا مناطق کروموزومی خاص را از مخلوط پیچیدهای از سلولها فراهم میکند. این روش به محققان اجازه میدهد تا جمعیت مشخصی از سلولها را براساس وجود یا عدم وجود پروتئینها یا نشانگرهای خاص جدا کنند. این رویکرد تجزیه و تحلیل مولکولی دقیق کروموزومهای منفرد، مانند تعیین توالی، نقشه برداری ژن و تشخیص ناهنجاریها کروموزومی را ممکن میسازد.
به عبارتی دیگر، تکنیک FACS یک نوع تخصصی از فلوسیتومتری محسوب میشود. در واقع، FACS روشی را برای مرتب سازی مخلوط ناهمگن سلولهای بیولوژیکی به دو یا چند ظرف، در یک زمان، براساس پراکندگی نوری خاص و ویژگیهای فلورسنت هر سلول ارائه میکند.
در این تکنیک، سوسپانسیون سلولی در مرکز یک مسیر مایع باریک قرار دارد و به سرعت جریان پیدا میکند. جریان به گونهای تنظیم شده است که بین سلولها نسبت به قطر آنها جدایی زیادی وجود دارد. یک مکانیسم ارتعاشی باعث میشود که جریان سلولها به قطرات منفرد بشکند. جریان از یک ایستگاه اندازهگیری فلورسانس عبور میکند که در آن ویژگی فلورسنت مورد نظر هر سلول اندازهگیری میشود.
جمع بندی
به طور کلی، تکنیکهای سیتوژنتیک مولکولی با ارائه ابزارهای قدرتمند برای تجزیه و تحلیل کروموزومها، ژنها و تغییرات ژنومی با دقت و وضوح بالا، تحولی در مطالعه زیست شناسی و ژنتیک کروموزومی ایجاد کرده است. تکنیکهای سیتوژنتیک، کاربردهای گستردهای در تحقیقات، تشخیص و عملکرد بالینی دارد و درک ما از بیماریهای ژنتیکی را ارتقا میدهد و همچنین به رویکردهای پزشکی شخصی کمک میکند.
سیتوژنتیک سرطان
کروموزوم فیلادلفیا اولین ناهنجاری کروموزومی بود که با استفاده از تکنیک سیتوژنتیک در سال 1960 در سرطان کشف شد. این ناهنجاری با لوسمی میلوئیدی مزمن مرتبط بود. در طول پنج دهه گذشته، پیشرفتهای فنی نوآورانه در زمینه سیتوژنتیک سرطان، توانایی تشخیص تغییرات کروموزومی را بسیار افزایش داده است و پتانسیل تحقیقاتی و تشخیصی مطالعات کروموزومی در نئوپلاسمها را تسهیل کرده است.
با وجود این پیشرفتها، تجزیه و تحلیل کروموزوم یک سلول منفرد هنوز ساده ترین راه برای تعیین و درک رابطه بین تکامل یک توده سلولی و پیشرفت بیماری سلولهای سرطانی محسوب میشود.
سیتوژنتیک سرطان به مطالعه ناهنجاریهای کروموزومی و تغییرات ژنتیکی در سلولهای سرطانی اشاره دارد. این ناهنجاریها نقش مهمی در ایجاد، پیشرفت و رفتار سرطان دارند. استفاده از تکنیکهای FISH پیشرفته، امکان شناسایی بیشتر تغییرات کروموزومی که با روش کاریوتایپینگ تشخیص داده نشده اند را فراهم میکند. این روش بر بسیاری از معایب ارزیابی تغییرات ژنتیکی در سلولهای سرطانی با کاریوتایپ غلبه کرده است.
متعاقباً، توسعه فناوریهای ریزآرایه DNA، دیدی با وضوح بالا از کل ژنوم ارائه میکند. این فناوری ممکن است مقادیر زیادی اطلاعات جدید به حوزه مطالعات سرطان اضافه کند و زمینه ساز ایجاد سیتوژنومیک سرطان شود.
به طور کلی، تجزیه و تحلیل سیتوژنتیک سلولهای سرطانی نقش مهمی در پروفایل مولکولی و پزشکی شخصی ایفا میکند. با شناسایی ناهنجاریهای کروموزومی خاص و تغییرات ژنتیکی در بیماران منفرد، پزشکان میتوانند استراتژیهای درمانی و درمانهای هدفمند را با توجه به ویژگیهای مولکولی سرطان تنظیم کنند.
علاوه بر این، تجزیه و تحلیل سیتوژنتیک سلولهای سرطانی اطلاعات پیش آگهی و تشخیصی ارزشمندی را در زمینه تشخیص سرطان ارائه میدهد. برخی از ناهنجاریهای کروموزومی با انواع خاص سرطان، تهاجمی بودن بیماری، پاسخ درمانی و نتایج درمان بیمار مرتبط است. درک مشخصات سیتوژنتیک سلولهای سرطانی میتواند به تصمیم گیری بالینی و مدیریت بیمار کمک کند.
جمع بندی
با توجه به مواردی که اشاره شد، سیتوژنتیک سرطان، نقش مهمی در درک اساس ژنتیکی سرطان، شناسایی اهداف درمانی بالقوه و بهبود مراقبت از بیمار از طریق استراتژیهای درمانی شخصی ایفا میکند. از طریق مطالعه ناهنجاریهای کروموزومی در سلولهای سرطانی، محققان و پزشکان قادر هستند اطلاعات مناسبی در مورد مکانیسمهای مولکولی که باعث توسعه و پیشرفت سرطان میشوند را به دست آورند.
وضعیت فعلی و آینده سیتوژنتیک
در حال حاضر، متخصصان سیتوژنتیک در حال توسعه رویکردهای مولکولی برای درک و شناخت ساختار، عملکرد و تکامل کروموزومها هستند.
سیتوژنتیک مرسوم که در حال حاضر مورد استفاده قرار می گیرد برای تجزیه و تحلیل کروموزومی از کاریوتایپ نواری منظم استفاده می کند که یک تکنیک ساده و محبوب برای دریافت یک دید کلی از ژنوم انسان به شمار میآید. این روشهای معمول تجزیه و تحلیل کاریوتایپ نواری، اکنون میتواند با M-FISH و تکنیکهای مولکولی مختلف دیگر ترکیب شده و منجر به تشخیص سریعتر و دقیقتر سندرمهای مختلف در کودکان شود.
پژوهشگران میتوانند با ترکیب روش CGH با multicolor FISH از آن به عنوان یک روش قدرتمند برای تجزیه و تحلیل 7 کاریوتیپ پیچیده استفاده کنند.
M-FISH روشهای سیتوژنتیک سنتی را تکمیل میکند و به درک بازآراییهای پیچیده کروموزومی و شناسایی تغییرات ساختاری غیرتصادفی کروموزوم که ممکن است با تکنیکها دیگر قابل تشخیص نباشد کمک میکند. تغییرات ژنومی در رده های سلولی متعدد تومور با استفاده از M-FISH قابل شناسایی است.
به طور کلی در حوزه سیتوژنتیک، باید این مهم را در نظر داشت که ناهنجاریهای کروموزومی به عنوان راهنمای طبیعت برای شناخت اساس مولکولی بسیاری از اختلالات غیرقابل توضیح انسانی به شمار میروند. از این رو، تکنیکهای سیتوژنتیک ابزاری ضروری برای تشخیص اختلالات ژنتیکی و راهنمایی برای اتخاذ روش درمان و مدیریت احتمالی بیماری محسوب میشوند.
منبع: pmc.ncbi.nlm.nih